题目内容
在常温条件下,将0.05
mol·L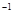 的盐酸与未知浓度的NaOH溶液以1:2的体积比混合,所得溶液的PH为2。用上述 NaOH溶液与某一元弱酸HA 20.0mL反应,恰好中和时消耗NaOH溶液10.0mL,所得溶液PH为10。求:
的盐酸与未知浓度的NaOH溶液以1:2的体积比混合,所得溶液的PH为2。用上述 NaOH溶液与某一元弱酸HA 20.0mL反应,恰好中和时消耗NaOH溶液10.0mL,所得溶液PH为10。求:
(1)C( NaOH)。
(2)C(HA)。
(3)盐类水解程度的大小可用“水解度(h)”来表示。对于NaA型盐的水解度(h)表示为:h =(已水解的物质的量÷原来总物质的量)×100﹪。求上述所得NaA溶液的水解度。
【答案】
(1)0.01 mol·L-1 (2)0.005 mol·L-1 (3)3%
【解析】
HCL---------NaOH--------HA
(0.05 mol·L .x-----C( NaOH).2x)/3x=0.02 C( NaOH)= 0.01 mol·L-1 C(HA)=0.005 mol·L-1
.x-----C( NaOH).2x)/3x=0.02 C( NaOH)= 0.01 mol·L-1 C(HA)=0.005 mol·L-1
C( NaOH).10-C(HA).20=30.10-4
NaA溶液的水解度=3%

练习册系列答案
相关题目
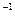 的盐酸与未知浓度的NaOH溶液以1:2的体积比混合,所得溶液的PH为2.用上述 NaOH溶液与某一元弱酸HA 20.0 mL反应,恰好中和时消耗NaOH溶液10.0mL,所得溶液PH为10.求:(1)C( NaOH)
的盐酸与未知浓度的NaOH溶液以1:2的体积比混合,所得溶液的PH为2.用上述 NaOH溶液与某一元弱酸HA 20.0 mL反应,恰好中和时消耗NaOH溶液10.0mL,所得溶液PH为10.求:(1)C( NaOH) 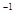 的盐酸与未知浓度的NaOH溶液以1:2的体积比混合,所得溶液的PH为2.用上述 NaOH溶液与某一元弱酸HA
20.0 mL反应,恰好中和时消耗NaOH溶液10.0mL,所得溶液PH为10.求:(1)C( NaOH)
的盐酸与未知浓度的NaOH溶液以1:2的体积比混合,所得溶液的PH为2.用上述 NaOH溶液与某一元弱酸HA
20.0 mL反应,恰好中和时消耗NaOH溶液10.0mL,所得溶液PH为10.求:(1)C( NaOH)