题目内容
常温下,下列各组离子在指定溶液中一定能大量共存的是 ( )
| A.无色透明的溶液:Na+、Al3+、Cl-、OH- |
| B.pH=1的溶液:Na+、NH4+、Cu2+、NO3- |
| C.与铝反应产生大量氢气的溶液:Na+、K+、Cl-、Al3+ |
| D.使紫色石蕊试液变红的溶液:Fe2+、Mg2+、NO3-、Cl- |
B
解析试题分析:A.无色透明的溶液中发生反应:Al3++4OH- =AlO2-+2H2O.不能大量共存。错误。B.pH=1的溶液是酸性溶液。H+、Na+、NH4+、Cu2+、NO3-不会发生任何反应。可以共存。正确。C.与铝反应产生大量氢气的溶液可能为酸性或碱性溶液。在碱性溶液中发生反应:Al3++4OH- =AlO2-+2H2O.不能大量共存。错误。D.使紫色石蕊试液变红的溶液是酸性溶液,在此条件下发生反应:3Fe2++4H++NO3-= 3Fe3++ NO↑+2H2O.不能大量共存。错误。
考点:考查离子共存问题的知识。

 金博士一点全通系列答案
金博士一点全通系列答案某地甲、乙两厂排放的污水中各含有下列8种离子中的4种(两厂废水所含离子不同):Ag+、Ba2+、Fe2+、Na+、Cl-、SO42-、NO3-、OH-。若两厂单独排放污水都会造成严重的水污染,如将两厂的污水按一定比例混合,沉淀后污水便能变得无色澄清,溶质主要含硝酸钠,污染程度大大降低。根据所给信息有以下几种说法,你认为正确的是
| A.Na+和NO3-来自同一工厂 | B.Cl-和NO3-一定来自同一工厂 |
| C.Ag+和Na+可能来自同一工厂 | D.SO42-和OH-一定来自同一工厂 |
在水溶液里或熔融状态下能导电的化合物是电解质。下列物质不属于电解质的是
| A.Fe | B.NaOH | C.H2SO4 | D.Na2SO4 |
(1)锡为第ⅣA族元素,锡的单质和化合物与某些物质的化学性质有许多相似之处。已知锡元素具有如下性质: ;
;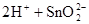



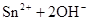 。
。
试回答:
①锡溶于盐酸,再向反应后的溶液中通入氯气,有关反应类似于铁的相应变化,试写出有关反应的化学方程式:_____________________________________________________,_______________________________________。
②将①中溶液蒸干后继续灼烧所得固体,变化过程类似于FeCl3溶液相应的变化,则最后得到的固体物质是__________(填化学式)。
③若可用SnCl2溶液与过量的碱溶液反应的方法制Sn(OH)2,该碱可选用________。
(2)某无色稀溶液X中,可能含有下表所列离子中的某几种。
| 阴离子 | 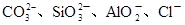 |
| 阳离子 |  |
现取该溶液适量,向其中加入某试剂Y,产生沉淀的物质的量(n)与加入试剂Y体积(V)的关系如图所示。

①若Y是盐酸,则溶液中含有的金属阳离子是_________,ab段发生反应的离子方程式为_______________,图中oa段参加反应的阴离子的物质的量之比为___________________。
②若Y是NaOH溶液,则bc段反应的离子方程式为____________________。
若不考虑离子的水解,忽略H+和OH-的影响,且溶液中只存在四种离子,则它们的离子个数比为_____________________________________________(按阳离子在前,阴离子在后,高价在前,低价在后的顺序排列)。
下列离子能在溶液中大量共存,当将溶液的pH调节至1时就会出现浑浊的是
| A.Fe2+、Fe3+、NH4+、NO3- | B.S2-、K+、I-、SO32- |
| C.Na+、I-、CO32-、NO3- | D.Al3+、HCO3-、OH-、Na+ |
下列各组的两种物质在溶液中的反应,可用同一离子方程式表示的是
| A.氢氧化钠与盐酸;氢氧化钠与碳酸 |
| B.BaCl2溶液与Na2SO4溶液;Ba(OH)2溶液与H2SO4溶液 |
| C.Na2CO3溶液与硝酸溶液;CaCO3溶液与硝酸溶液 |
| D.石灰石与硝酸反应;石灰石与盐酸 |
下列叙述正确的是
| A.固体氯化钠不导电,所以氯化钠不是电解质 |
| B.铜丝能导电,所以铜是电解质 |
| C.氯化氢水溶液能导电,所以氯化氢是电解质 |
| D.SO3 溶于水能导电,所以 SO3 是电解质 |
下列各组离子在溶液中能大量共存的是
A.Na+、Al3+、Cl-、 | B.Cu2+、Cl-、 、OH- 、OH- |
C.Ca2+、Na+、 、 、 | D.H+、 、 、 、OH- 、OH- |
下列各组中两种物质在溶液里的反应,可用同一离子方程式表示的是
| A.KCl+AgNO3;AlCl3+ AgNO3 |
| B.NaHCO3+H2SO4;Na2CO3+HCl |
| C.NaHCO3+NaOH;Ca(HCO3)+KOH |
| D.BaCl2+H2SO4;Ba(OH)2+H2SO4 |