题目内容
【题目】当温度高于500 K时,科学家成功利用二氧化碳和氢气合成了乙醇,这在节能减排、降低碳排放方面具有重大意义。
回答下列问题:
(1)该反应的化学方程式为___________________________。
(2)在恒容密闭容器中,判断上述反应达到平衡状态的依据是___________(填序号)。
a.体系压强不再改变
b.H2的浓度不再改变
c.气体的密度不随时间改变
d.单位时间内消耗H2和CO2的物质的量之比为3∶1
(3)已知:1 g氢气完全燃烧生成液态水,放出143 kJ热量;23 g乙醇完全燃烧生成液态水和二氧化碳,放出650 kJ热量,则氢气和乙醇的燃烧热的比值为____________(要求计算出数值)。
(4)在一定压强下,测得由CO2制取CH3CH2OH的实验数据中,起始投料比、温度与CO2的转化率的关系如图所示。

根据图中数据分析:
①降低温度,平衡向________________方向移动。
②在700 K、起始投料比![]() =1.5时,H2的转化率为______________。
=1.5时,H2的转化率为______________。
③在500 K、起始投料比![]() =2时,达到平衡后H2的浓度为a mol·L1,则达到平衡时CH3CH2OH的浓度为___________。
=2时,达到平衡后H2的浓度为a mol·L1,则达到平衡时CH3CH2OH的浓度为___________。
【答案】(1)2CO2+6H2![]() C2H5OH+3H2O
C2H5OH+3H2O
(2)ab (3)0.22
(4)①正反应(或右) ②40% ③1.5a mol·L1
【解析】(1)由题给信息可得该反应的化学方程式为2CO2+6H2![]() C2H5OH+3H2O。
C2H5OH+3H2O。
(2)该反应为气体分子数减小的化学反应,当体系的压强不再改变时,反应达到平衡状态,另外氢气的浓度不再变化,也能说明反应达到平衡状态;由于在500 K时,所有物质均为气体,故在恒容状态下气体的密度恒为定值,密度不变不能说明反应达到平衡状态;根据化学方程式可知,任何单位时间内消耗H2和CO2的物质的量之比均为3∶1。
(3)由题给信息可分别写出氢气和乙醇燃烧的热化学方程式:H2(g)+![]() O2(g)
O2(g)![]() H2O(l) ΔH=286 kJ/mol 和CH3CH2OH(l)+3O2(g)
H2O(l) ΔH=286 kJ/mol 和CH3CH2OH(l)+3O2(g)![]() 2CO2(g)+3H2O(l) ΔH=1 300 kJ/mol,从而可求得氢气和乙醇的燃烧热的比值为0.22。
2CO2(g)+3H2O(l) ΔH=1 300 kJ/mol,从而可求得氢气和乙醇的燃烧热的比值为0.22。
(4)①由图中信息可知,其他条件不变时,升高温度,CO2的转化率降低,说明平衡向逆反应方向移动,故正反应为放热反应,即降低温度,平衡将向正反应方向移动。
②700 K时,当氢气与二氧化碳的起始投料比![]() =1.5时,由图像可知二氧化碳的转化率为20%,由化学方程式:2CO2+6H2
=1.5时,由图像可知二氧化碳的转化率为20%,由化学方程式:2CO2+6H2![]() C2H5OH+3H2O,可计算出氢气的转化率为40%。
C2H5OH+3H2O,可计算出氢气的转化率为40%。
③设起始时c(CO2)=x mol·L1,则起始时c(H2)=2x mol·L1,有
2CO2+6H2![]() C2H5OH+3H2O
C2H5OH+3H2O
起始浓度(mol·L1):x 2x 0 0
转化浓度(mol·L1): 0.6x 1.8x 0.3x 0.9x
平衡浓度(mol·L1): 0.4x 0.2x 0.3x 0.9x
0.2x=a,得x=5a,平衡时c(CH3CH2OH)=0.3x mol·L1=1.5a mol·L1。

【题目】用酸性KMnO4和H2C2O4(草酸)反应研究影响反应速率的因素。一实验小组欲通过测定单位时间内生成CO2的速率,探究某种影响化学反应速率的因素,设计实验方案如下(KMnO4溶液已酸化):
实验序号 | A溶液 | B溶液 |
① | 20 mL 0.1 mol·L-1H2C2O4溶液 | 30 mL 0.01 mol·L-1KMnO4溶液 |
② | 20 mL 0.2 mol·L-1H2C2O4溶液 | 30 mL 0.01 mol·L-1KMnO4溶液 |

(1)该反应的离子方程式 。(已知H2C2O4是二元弱酸)
(2)该实验探究的是 因素对化学反应速率的影响。相同时间内针筒中所得CO2的体积大小关系是 < (填实验序号)。
(3)若实验①在2 min末收集了2.24 mL CO2(标准状况下),则在2 min末, c(MnO4-)=__________mol/L(假设混合液体积为50 mL)
(4)除通过测定一定时间内CO2的体积来比较反应速率,本实验还可通过测定 来比较化学反应速率。(一条即可)
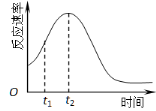 (5)小组同学发现反应速率总是如图,其中t1~t2时间内速率变快的主要原因可能是:
(5)小组同学发现反应速率总是如图,其中t1~t2时间内速率变快的主要原因可能是:

① ;② 。

