МвДҝДЪИЭ
ЎҫМвДҝЎҝНРМШВЮ¶ЁMәПіЙВ·ҫ¶ИзПВЈЁ·ҙУҰМхјюТСВФИҘЈ©Јә

ТСЦӘРЕПўЈәўЩ ЈЁІ»ОИ¶ЁЈ©
ЈЁІ»ОИ¶ЁЈ©
ўЪ
ўЫGУц![]() ИЬТәПФЧПЙ«Ј¬HЦРә¬УР3ёцБщФӘ»·
ИЬТәПФЧПЙ«Ј¬HЦРә¬УР3ёцБщФӘ»·
Зл»ШҙрЈә
ЈЁ1Ј©MөД·ЦЧУКҪКЗ__________Ј¬»ҜәПОпKөДҪб№№јтКҪКЗ______________ЎЈ
ЈЁ2Ј©ПВБРЛө·ЁХэИ·өДКЗ__________
A.»ҜәПОпBЧӘ»ҜОӘCКЗПыИҘ·ҙУҰЈ¬FЧӘ»ҜОӘGКЗИЎҙъ·ҙУҰ
B.»ҜәПОпCЧӘ»ҜОӘDөД·ҙУҰј°FЧӘ»ҜОӘGөД·ҙУҰ¶јЦ»РијУИлЗҝјоәуЛ®ҪвјҙҝЙ
C.![]() »ҜәПОпIУл
»ҜәПОпIУл![]() ·ҙУҰЈ¬Чо¶аПыәД
·ҙУҰЈ¬Чо¶аПыәД![]()
D.өИОпЦКөДБҝөДAәНDНкИ«ИјЙХПыәДөДСхЖшБҝПаөИ
ЈЁ3Ј©Рҙіц![]() өД»ҜС§·ҪіМКҪЈә__________________.
өД»ҜС§·ҪіМКҪЈә__________________.
ЈЁ4Ј©MөДН¬ПөОп![]() УР¶аЦЦН¬·ЦТм№№МеЈ¬Н¬Кұ·ыәППВБРМхјюөДН¬·ЦТм№№МеөДҪб№№јтКҪИз
УР¶аЦЦН¬·ЦТм№№МеЈ¬Н¬Кұ·ыәППВБРМхјюөДН¬·ЦТм№№МеөДҪб№№јтКҪИз Ј¬ЗлФЩРҙіц3ЦЦЈә____________________ЎЈ
Ј¬ЗлФЩРҙіц3ЦЦЈә____________________ЎЈ
ўЩ·ЦЧУЦРә¬УР2ёц¶АБўөДұҪ»·Ј»
ўЪ![]() ЖЧәН
ЖЧәН![]() ЖЧјмІвПФКҫ·ЦЧУЦРУР5ЦЦ»ҜС§»·ҫіІ»Н¬өДЗвФӯЧУЈ¬УР
ЖЧјмІвПФКҫ·ЦЧУЦРУР5ЦЦ»ҜС§»·ҫіІ»Н¬өДЗвФӯЧУЈ¬УР![]() јьЈ¬ОЮ
јьЈ¬ОЮ![]() јьәН
јьәН![]() јьЎЈ
јьЎЈ
ЈЁ5Ј©ЙијЖТФјЧұҪәНТТЛбфыЈЁ Ј©ОӘФӯБПЦЖұёDИв№рЛбЈЁ
Ј©ОӘФӯБПЦЖұёDИв№рЛбЈЁ Ј©өДәПіЙВ·ПЯЈЁОЮ»ъКФјБИОСЎЈ¬әПіЙЦРРлУГөҪЙПКцТСЦӘРЕПўўЩўЪ.УГБчіМНјұнКҫЈ©Јә__________________________________________________________
Ј©өДәПіЙВ·ПЯЈЁОЮ»ъКФјБИОСЎЈ¬әПіЙЦРРлУГөҪЙПКцТСЦӘРЕПўўЩўЪ.УГБчіМНјұнКҫЈ©Јә__________________________________________________________
Ўҫҙр°ёЎҝ![]()
 AD
AD 
 +H2O
+H2O 







ЎҫҪвОцЎҝ
ёщҫЭәПіЙНјҝЙЦӘЈ¬AЎъBЎъCЎъDөДЧӘ»ҜЈ¬AЎъBЈ¬ҪбәП·ЦЧУКҪөДұд»ҜЈ¬өГЦӘёГ·ҙУҰОӘCH=CH2јУіЙ·ҙУҰЈ¬өГіцAОӘұҪТТП©ЈЁ Ј©Ј¬BЎъCЎъDөДЧӘ»ҜЈ¬ҪбәП·ЦЧУКҪөДұд»ҜәНDөДҪб№№ЈЁ
Ј©Ј¬BЎъCЎъDөДЧӘ»ҜЈ¬ҪбәП·ЦЧУКҪөДұд»ҜәНDөДҪб№№ЈЁ Ј©Ј¬ҝЙТФЕР¶ПіцBЎъCОӘПыИҘ·ҙУҰЈ¬CЎъDФтОӘВұҙъМюөДЛ®ҪвЈ¬ҙУРЕПўўЩ
Ј©Ј¬ҝЙТФЕР¶ПіцBЎъCОӘПыИҘ·ҙУҰЈ¬CЎъDФтОӘВұҙъМюөДЛ®ҪвЈ¬ҙУРЕПўўЩ
ҝЙТФөГіцDҪб№№ЦРфИ»щөДУЙАҙЎЈёщҫЭРЕПўўЫөГЦӘ![]() ОӘ·УАаЈ¬ФЩ¶ФұИDәНIөДМјБҙҪб№№Ј¬ҝЙТФOHөГЦӘGөДҪб№№ОӘ
ОӘ·УАаЈ¬ФЩ¶ФұИDәНIөДМјБҙҪб№№Ј¬ҝЙТФOHөГЦӘGөДҪб№№ОӘ Ј¬¶шәуНЖЦӘEәНFөДҪб№№јтКҪ·ЦұрОӘ
Ј¬¶шәуНЖЦӘEәНFөДҪб№№јтКҪ·ЦұрОӘ әН
әН ЎЈHЦРә¬УР3ёцБщФӘ»·Ј¬HЎъIөДәПіЙНЁ№эМјФӯЧУКэөД№ШПөЈ¬ҝЙЦӘ
ЎЈHЦРә¬УР3ёцБщФӘ»·Ј¬HЎъIөДәПіЙНЁ№эМјФӯЧУКэөД№ШПөЈ¬ҝЙЦӘ![]() әН
әН![]() јЧҙј
јЧҙј![]() өвјЧНй
өвјЧНй![]() ·ҙУҰЈ¬ҪбәП»ҜәПОпIҪб№№ЦРөД
·ҙУҰЈ¬ҪбәП»ҜәПОпIҪб№№ЦРөД![]() әНHөДІ»ұҘәН¶ИЈ¬ДжПтНЖөјЈ¬өГіцHөДҪб№№ОӘ
әНHөДІ»ұҘәН¶ИЈ¬ДжПтНЖөјЈ¬өГіцHөДҪб№№ОӘ Ј»ҪбәПHөДІ»ұҘәН¶ИәНIөДҪб№№Ј¬ТІҝЙТФХэПтНЖөјіцHөДҪб№№Ј»ФЩҝҙJЎъMөДЧӘ»ҜТСЦӘKөД·ЦЧУКҪОӘ
Ј»ҪбәПHөДІ»ұҘәН¶ИәНIөДҪб№№Ј¬ТІҝЙТФХэПтНЖөјіцHөДҪб№№Ј»ФЩҝҙJЎъMөДЧӘ»ҜТСЦӘKөД·ЦЧУКҪОӘ![]() Ј¬ұҘәНЈ¬¶ФұИJәНMөДҪб№№Ј¬НЖЦӘKОӘ
Ј¬ұҘәНЈ¬¶ФұИJәНMөДҪб№№Ј¬НЖЦӘKОӘ Ј¬ёГ·ҙУҰОӘИЎҙъ·ҙУҰЈ¬ҫЭҙЛ·ЦОцЧчҙрЎЈ
Ј¬ёГ·ҙУҰОӘИЎҙъ·ҙУҰЈ¬ҫЭҙЛ·ЦОцЧчҙрЎЈ
ЈЁ1Ј©ёщҫЭҪб№№јтКҪҝЙөГіцM·ЦЧУКҪОӘ![]() Ј¬УЙHЙПКцНЖөј№эіМҝЙөГіцKөДҪб№№јтКҪОӘ
Ј¬УЙHЙПКцНЖөј№эіМҝЙөГіцKөДҪб№№јтКҪОӘ Ј»
Ј»
ЈЁ2Ј©A. ҙУЙПКц·ЦОцЦРҝЙөГЦӘ»ҜәПОпBЧӘ»ҜОӘCКЗПыИҘ·ҙУҰЈ¬FЧӘ»ҜОӘGКЗИЎҙъ·ҙУҰЈ¬AПоХэИ·Ј»
B. »ҜәПОпCЧӘ»ҜОӘDЎўFЧӘ»ҜОӘG¶јРијУИлЗҝјоәуЛ®ҪвЈ¬ФЩјУЛбЛб»Ҝәу·ҪҝЙөГөҪЈ¬BПоҙнОуЈ»
C. ![]() »ҜәПОпIЦРә¬УР
»ҜәПОпIЦРә¬УР![]() хҘ»щЈ¬Чо¶аПыәД
хҘ»щЈ¬Чо¶аПыәД![]() Ј¬CПоҙнОуЈ»
Ј¬CПоҙнОуЈ»
D. ә¬МјЎўЗвФӘЛШөДОпЦКНкИ«ИјЙХЙъіЙ![]() әН
әН![]() Ј¬ёщҫЭ·ЦЧУКҪЈ¬ҝЙөГіц
Ј¬ёщҫЭ·ЦЧУКҪЈ¬ҝЙөГіц![]() әН
әН![]() НкИ«ИјЙХПыәДөДСхЖшБҝ¶јОӘ
НкИ«ИјЙХПыәДөДСхЖшБҝ¶јОӘ![]() Ј¬DПоХэИ·Ј»
Ј¬DПоХэИ·Ј»
№Кҙр°ёОӘЈәADЈ»
ЈЁ3Ј©![]() өД»ҜС§·ҪіМКҪОӘ
өД»ҜС§·ҪіМКҪОӘ

 ЎЈ
ЎЈ
ЈЁ4Ј©ёщҫЭMөДН¬ПөОп![]() Ј¬УРБҪёц¶АБўөДұҪ»·Ј¬ЗТ
Ј¬УРБҪёц¶АБўөДұҪ»·Ј¬ЗТ![]() ЖЧәН
ЖЧәН![]() ЖЧјмІвПФКҫ·ЦЧУЦРУР5ЦЦ»ҜС§»·ҫіІ»Н¬өДЗвФӯЧУЈ¬УР
ЖЧјмІвПФКҫ·ЦЧУЦРУР5ЦЦ»ҜС§»·ҫіІ»Н¬өДЗвФӯЧУЈ¬УР![]() јьЈ¬ОЮ
јьЈ¬ОЮ![]() јьәН
јьәН![]() јьЈ¬ҪбәПҝХјд¶ФіЖРФЛјПлҝЙЦӘЈ¬ВъЧгЙПКцМхјюөДУР»ъОпҪб№№јтКҪОӘЈә
јьЈ¬ҪбәПҝХјд¶ФіЖРФЛјПлҝЙЦӘЈ¬ВъЧгЙПКцМхјюөДУР»ъОпҪб№№јтКҪОӘЈә Ј»
Ј»
ЈЁ5Ј©ТТЛбфыЈЁ Ј©НЁ№эЛ®ҪвҝЙТФ»сөГДҝұкІъОпЈЁ
Ј©НЁ№эЛ®ҪвҝЙТФ»сөГДҝұкІъОпЈЁ Ј©ЦРөДфИ»щЈ¬УР»ъәПіЙЦРТӘУГөҪРЕПўўЩәНўЪЈ¬ҪбәПФӯБПәНРЕПўўЪЈ¬¶ФұИІъОпөДМјБҙҪб№№әНМјФӯЧУКэЈ¬ҝЙНЖЦӘ
Ј©ЦРөДфИ»щЈ¬УР»ъәПіЙЦРТӘУГөҪРЕПўўЩәНўЪЈ¬ҪбәПФӯБПәНРЕПўўЪЈ¬¶ФұИІъОпөДМјБҙҪб№№әНМјФӯЧУКэЈ¬ҝЙНЖЦӘ Ј¬РиПИУл
Ј¬РиПИУл ·ҙУҰЙъіЙ
·ҙУҰЙъіЙ Ј¬ФЩ·ўЙъПыИҘ·ҙУҰЙъіЙ
Ј¬ФЩ·ўЙъПыИҘ·ҙУҰЙъіЙ Ј¬Чоәу·ўЙъЛ®Ҫв·ҙУҰҝЙөГДҝұкІъОпЈ¬ҪбәПФӯБП
Ј¬Чоәу·ўЙъЛ®Ҫв·ҙУҰҝЙөГДҝұкІъОпЈ¬ҪбәПФӯБП әНРЕПўўЩЈ¬ХэПтЎўДжПтНЖөјПаҪбәПЈ¬ҝЙөГіцЦЖұёБчіМЈ¬ЖдҫЯМеБчіМИзПВЈә
әНРЕПўўЩЈ¬ХэПтЎўДжПтНЖөјПаҪбәПЈ¬ҝЙөГіцЦЖұёБчіМЈ¬ЖдҫЯМеБчіМИзПВЈә






 ЎЈ
ЎЈ

ЎҫМвДҝЎҝ№ӨТөЙПУГДСИЬУЪЛ®өДМјЛбпИ(SrCO3)·ЫД©ОӘФӯБП(ә¬ЙЩБҝұөәНМъөД»ҜәПОп)ЦЖұёёЯҙҝБщЛ®ВИ»ҜпИҫ§Ме(SrCl26H2O)Ј¬Жд№эіМОӘЈә
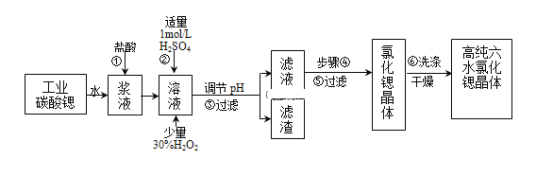
ТСЦӘЈәўсЈ®УР№ШЗвСх»ҜОпіБөнөДpHЈә
ЗвСх»ҜОп | Fe(OH)3 | Fe(OH)2 |
ҝӘКјіБөнөДpH | 1.5 | 6.5 |
іБөнНкИ«өДpH | 3.7 | 9.7 |
ўтЈ®SrCl26H2Oҫ§МеФЪ61ЎжКұҝӘКјК§ИҘҪбҫ§Л®Ј¬100ЎжКұК§ИҘИ«ІҝҪбҫ§Л®Ј®
(1)ІЩЧчўЩРиТӘјУҝм·ҙУҰЛЩВКЈ¬ҙлК©УРід·ЦҪБ°иәН______(РҙТ»ЦЦ)Ј®МјЛбпИУлСОЛб·ҙУҰөДАлЧУ·ҪіМКҪ______Ј®
(2)ФЪІҪЦиўЪ-ўЫөД№эіМЦРЈ¬Ҫ«ИЬТәөДpHЦөУЙ1өчҪЪЦБ______Ј»ТЛУГөДКФјБОӘ______Ј®
A.1.5B.3.7C.9.7DЈ®°ұЛ®EЈ®ЗвСх»ҜпИ·ЫД©FЈ®МјЛбДЖҫ§Ме
(3)ІЩЧчўЫЦРЛщөГВЛФьөДЦчТӘіЙ·ЦКЗ______(Мо»ҜС§КҪ)Ј®
(4)№ӨТөЙПУГИИ·зҙөёЙБщЛ®ВИ»ҜпИЈ¬ККТЛөДОВ¶ИКЗ______
AЈ®50Ў«60ЎжBЈ®80Ў«100ЎжCЈ®100ЎжТФЙП
ЎҫМвДҝЎҝ¶МЦЬЖЪФӘЛШAЎўBЎўCЎўDФЪФӘЛШЦЬЖЪұнЦРөДПа¶ФО»ЦГИзұнЛщКҫЈ¬ТСЦӘAФӯЧУЧоНвІгөзЧУКэУлҙОНвІгөзЧУКэЦ®ұИОӘ2Јә1ЎЈEәНCЎўDН¬ЦЬЖЪЈ¬ЛьөДФӯЧУРтКэұИB¶а6ЎЈ
»ШҙрПВБРОКМвЈә
A | B | ||
C | D |
(1)ИЛөДә№ТәЦРә¬УРDөДјтөҘАлЧУЈ¬ЖдАлЧУҪб№№КҫТвНјОӘ______Ј¬ФӘЛШCФЪФӘЛШЦЬЖЪұнЦРөДО»ЦГКЗ______ЎЈCөДЧоёЯјЫСх»ҜОпөДЛ®»ҜОпөДЕЁИЬТәПЎКНөД·Ҫ·ЁКЗ______ЎЈ
(2)AөДЧоёЯјЫСх»ҜОпөД»ҜС§КҪОӘ_____Ј¬Лщә¬өД»ҜС§јьАаРНКЗ______ЈЁМоЎ°АлЧУјьЎұ»тЎ°№ІјЫјьЎұЈ©ЎЈ
(3)EөДЧоёЯјЫСх»ҜОп¶ФУҰөДЛ®»ҜОпөД»ҜС§КҪОӘ____Ј¬ЛьКЗ______ЈЁМоЎ°ЛбРФЎұ»тЎ°БҪРФЎұ»тЎ°јоРФЎұЈ©»ҜәПОпЎЈРҙіцёГ»ҜәПОпУлЗвСх»ҜДЖИЬТә·ҙУҰөДАлЧУ·ҪіМКҪ______ЎЈ
(4)јУИИКұЈ¬BөДЧоёЯјЫСх»ҜОп¶ФУҰЛ®әПОпөДЕЁИЬТәУлөҘЦКA·ҙУҰөД»ҜС§·ҪіМКҪОӘ(УГҫЯМеөД»ҜС§КҪұнКҫ)______ЎЈ
ЎҫМвДҝЎҝХэ¶ЎИ©КЗТ»ЦЦ»Ҝ№ӨФӯБПЎЈДіКөСйРЎЧйАыУГИзПВЧ°ЦГәПіЙХэ¶ЎИ©ЎЈЛщ·ўЙъөДЧӘ»Ҝ№эіМОӘCH3CH2CH2CH2OH![]() CH3CH2CH2CHOЎЈ
CH3CH2CH2CHOЎЈ

·ҙУҰОпәНІъОпөДПа№ШОпАнРФЦКИзұнЛщКҫЎЈ
РФЦК | ·Рөг/Ўж | ГЬ¶И/gЎӨcm-3 | Л®ЦРИЬҪвРФ |
Хэ¶Ўҙј | 117.2 | 0.810 9 | ОўИЬ |
Хэ¶ЎИ© | 75.7 | 0.801 7 | ОўИЬ |
КөСйІҪЦиИзПВЈә
Ҫ«6.0g Na2Cr2O7·ЕИл100mLЙХұӯЦРЈ¬јУ30mLЛ®ИЬҪвЈ¬ФЩ»әВэјУИл5mLЕЁБтЛбЈ¬Ҫ«ЛщөГИЬТәРЎРДЧӘТЖЦБBЦРЎЈФЪAЦРјУИл4.0gХэ¶ЎҙјәНјёБЈ·РКҜЈ¬јУИИЎЈөұУРХфЖшіцПЦКұЈ¬ҝӘКјөОјУBЦРИЬТәЎЈөОјУ№эіМЦРұЈіЦ·ҙУҰОВ¶ИОӘ90Ў«95ЎжЈ¬ФЪEЦРКХјҜ90ЎжТФЙПөДБу·ЦЎЈҪ«БуіцОпө№Ил·ЦТәВ©¶·ЦРЈ¬·ЦИҘЛ®ІгЈ¬Ҫ«УР»ъІгёЙФпәуХфБуЈ¬КХјҜ75Ў«77ЎжБу·ЦЈ¬ІъБҝОӘ2.0 gЎЈ
»ШҙрПВБРОКМвЈә
ЈЁ1Ј©КөСйЦРЈ¬ДЬ·сҪ«Na2Cr2O7ИЬТәјУИлЕЁБтЛбЦРЈ¬ЛөГчАнУЙЈә___________ЎЈ
ЈЁ2Ј©јУИл·РКҜөДЧчУГКЗ___________Ј¬ИфјУИИәу·ўПЦОҙјУИл·РКҜЈ¬УҰІЙИЎөДХэИ·ҙлК©КЗ___________ЎЈ
ЈЁ3Ј©ЙПКцЧ°ЦГНјЦРЈ¬BТЗЖчөДГыіЖКЗ____Ј¬DТЗЖчөДГыіЖКЗ_______ЎЈ
ЈЁ4Ј©Ҫ«Хэ¶ЎИ©ҙЦІъЖ·ЦГУЪ·ЦТәВ©¶·ЦР·ЦАлЛ®КұЈ¬Л®ФЪ______(МоЎ°ЙПЎұ»тЎ°ПВЎұ)ІгЎЈ
ЈЁ5Ј©·ҙУҰОВ¶ИУҰұЈіЦФЪ90Ў«95ЎжЈ¬ЖдФӯТтКЗ______________________ЎЈ
ЈЁ6Ј©ұҫКөСйЦРЈ¬Хэ¶ЎИ©өДІъВКОӘ_____%ЎЈ

