题目内容
(8分)下图表示的是向Na2CO3溶液中滴入稀盐酸(单位为ml)时产生CO2的过程。
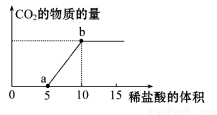
(1)写出a点以前发生反应的离子方程式:
(2)写出a到b点发生反应的离子方程式:
(3)若某Na2CO3溶液中含84.8g Na2CO3,向其中滴入一定量的稀盐酸,恰好使溶液中Cl-和HCO3-的物质的量之比为2∶1,则滴入的稀盐酸中的HCl的物质的量为 mol(保留小数点后两位数字)。
(4)已知HCO3-+OH-=== CO32-+H2O ,若某溶液中含1 mol NaHCO3,滴入一定量的稀NaOH,恰好使溶液中Na+ 和HCO3-的物质的量之比为2:1,则滴入的NaOH的物质的量为 mol。
(1)CO32-+H+=== HCO3- (2)HCO3-+H+===CO2↑+H2O (3)1.07 (4)1/3
【解析】
试题分析:向碳酸钠溶液中滴入稀盐酸,先反应生成碳酸氢钠和氯化钠,再反应生成氯化钠、二氧化碳和水,(1)a点以前发生反应的离子方程式为CO32-+H+=== H CO3-;(2)a到b点发生反应的离子方程式为HCO3-+H+===CO2↑+H2O;
(3)根据反应Na2CO3+HCl = NaCl+NaHCO3 NaHCO3+HCl=NaCl+CO2↑+H2O
0.8 0.8 0.8 0.8 x x x
列方程(0.8+x):(0.8-x)= 2:1 解得x=0.8/3 则HCl的物质的量为0.8+0.8/3=1.07;
(4)根据HCO3-+OH-=== CO32-+H2O
X X
列方程(X+1)/(1-X)=2:1 解得 X=1/3,则滴入的NaOH的物质的量为1/3mol。
考点:考查碳酸钠的化学性质。

 名校课堂系列答案
名校课堂系列答案 与6.
与6. 个水分子的质量(g)在数值上相等
个水分子的质量(g)在数值上相等  个氮分子和6.
个氮分子和6. 个氢分子的质量比等于14∶1
个氢分子的质量比等于14∶1