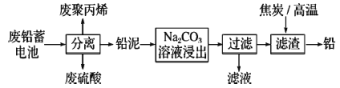
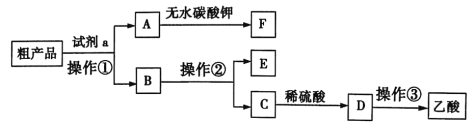
题目内容
【题目】加热某纯净的小苏打(NaHCO3)样品至固体质量不再变化,得到固体(Na2CO3)质量31.8g,将该固体溶于水配制成500mL溶液,计算:
(1)产生的气体冷却至标准状况下,其体积为多少升?______________
(2)求所得溶液中Na+的物质的量浓度?_______________
【答案】6.72L 1.2mol/L
【解析】
(1)加热小苏打发生反应:2NaHCO3![]() Na2CO3+H2O↑+CO2↑,生成的n(Na2CO3)=
Na2CO3+H2O↑+CO2↑,生成的n(Na2CO3)=![]() =0.3mol;冷却至标况气体为CO2,根据方程式可知n(CO2)= n(Na2CO3)=0.3mol,标况下体积为0.3mol×22.4L/mol=6.72L;
=0.3mol;冷却至标况气体为CO2,根据方程式可知n(CO2)= n(Na2CO3)=0.3mol,标况下体积为0.3mol×22.4L/mol=6.72L;
(2)n(Na+)=2n(Na2CO3)=0.6mol,所以物质的量浓度为:![]() =1.2mol/L。
=1.2mol/L。

练习册系列答案
相关题目