题目内容
4.下列变化中:①合成氨,②闪电固氮,③二氧化氮与水反应;按氮元素被氧化、被还原、既被氧化又被还原的顺序排列正确的是( )| A. | ①②③ | B. | ②①③ | C. | ①③② | D. | ③①② |
分析 氧化还原反应的特征为有化合价的升降,根据元素化合价的变化判断对应物质在反应中的性质,化合价升高,元素被氧化,化合价降低,元素被还原.
解答 解:①合成氨,是氮气和氢气反应生成氨气的过程,氮元素化合价降低,N元素被还原;
②大气通过闪电固氮,是氮气和氧气反应生成一氧化氮的过程,氮元素化合价升高,N元素被氧化;
③二氧化氮溶于水中生成硝酸和一氧化氮,氮元素化合价既升高又降低,所以氮元素既被氧化又被还原.
氮元素被氧化、被还原、既被氧化又被还原的顺序排列为②①③.
故选B.
点评 本题考查氧化还原反应中被氧化和被还原的概念,题目难度不大,注意把握物质的性质,结合元素化合价的变化来进行判断即可.

练习册系列答案
相关题目
14.下列说法中不正确的是( )
| A. | Ba2+对人体无害,可用BaSO4做钡餐造影剂 | |
| B. | 海水提镁和海水提溴都涉及氧化还原反应 | |
| C. | 大量燃烧含硫的化石燃料是形成酸雨的主要原因 | |
| D. | 航天飞机上的陶瓷防护片属于新型无机非金属材料 |
15.下列实验操作正确的是( )
| A. |  滴加液体 | B. | 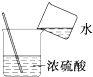 稀释浓硫酸 | C. |  检查气密性 | D. | 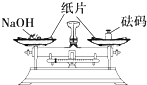 称量NaOH固体 称量NaOH固体 |
12.设NA为阿伏加德罗常数,下列叙述中正确的是( )
| A. | 足量铁在氯气中反应,1mol铁失去的电子数为2NA | |
| B. | 标准状况下22.4LH2中含中子数为2NA | |
| C. | NaBH4是一种重要的储氢载体,1molNaBH4与水反应[NaBH4+2H2O=NaBO2+4H2↑]时转移的电子数目为8NA | |
| D. | 常温下,1L0.2mol/L的盐酸溶液通人氨气当溶液pH=7,则溶液中NH4+数为0.2NA |
19.己知:①CO(g)+H2O(g)═CO2(g)+H2(g)△H1,②CH4(g)+H2O(g)═CO(g)+3H2(g)△H2
下列推断正确的是( )
下列推断正确的是( )
| A. | 若CO的燃烧热为△H3,则H2的燃烧热为△H3-△H1 | |
| B. | 反应CH4(g)+CO2(g)═2CO(g)+2H2(g)的△H=△H${\;}_{{\;}_{2}}$-△H1 | |
| C. | 若反应②的反应物总能量低于生成物总能量,则△H2<0 | |
| D. | 若等物质的量的CO和H2完全燃烧生成气态产物时前者放热更多,则△H1>0 |
9.常温下,将pH=a的某一元酸HA溶液与pH=b的NaOH溶液等体积混合,充分反应.下列叙述一定正确的是( )
| A. | 若n(HA)=n(NaOH),则a+b≥14 | B. | 若n(HA)>n(NaOH),则a+b<14 | ||
| C. | 若混合后溶液pH=7,则n(HA)≥n(NaOH) | D. | 若混合后溶液pH>7,则n(HA)<n(NaOH) |
16.下列NH3的制备、收集或性质检验装置,正确的是( )
| A. |  制取收集 | B. |  排液收集 | C. |  尾气吸收 | D. |  喷泉实验 |
13.下列做法中,不利于保护水资源的是( )
| A. | 使用节水型马桶 | B. | 生活污水任意排放 | ||
| C. | 合理使用农药和化肥 | D. | 工业废水处理达标后排放 |
14.现有短周期元素X、Y、Z、M,周期表中元素X的原子半径最小,Y原子最外层电子数是次外层的3倍,Z的化合物焰色反应为黄色,Y和M同主族.下列说法不正确的是( )
| A. | 气态氢化物的稳定性:Y<M | |
| B. | 简单离子半径由大到小的顺序是:M>Y>Z | |
| C. | 化合物Z2Y2 中含有离子键和非极性共价键 | |
| D. | 等浓度的X2M与Z2M的溶液中,水的电离程度:X2M<Z2M |