题目内容
写出下列物质在水溶液中的电离方程式.
(1)HClO .
(2)CH3COONa .
(3)NH3?H2O .
(1)HClO
(2)CH3COONa
(3)NH3?H2O
考点:电离方程式的书写
专题:电离平衡与溶液的pH专题
分析:强电解质在溶液中能完全电离用“=”,弱电解质部分电离用“?”,多元弱酸,应分步电离,离子团在电离方程式中不能拆开,据此进行分析解答.
解答:
解:(1)次氯酸为弱电解质,部分电离出氢离子和次氯酸根离子,电离方程式为:HClO  H++ClO-;
H++ClO-;
故答案为:HClO H++ClO-;
H++ClO-;
(2)醋酸钠为强电解质,完全电离出醋酸根离子和钠离子,电离方程式:CH3COONa=CH3COO-+Na+;
故答案为::CH3COONa=CH3COO-+Na+;
(3)一水合氨为弱电解质,部分电离出氨根离子和氢氧根离子,电离方程式为:NH3?H2O NH4++OH-;
NH4++OH-;
故答案为:NH3?H2O NH4++OH-.
NH4++OH-.
 H++ClO-;
H++ClO-;故答案为:HClO
 H++ClO-;
H++ClO-;(2)醋酸钠为强电解质,完全电离出醋酸根离子和钠离子,电离方程式:CH3COONa=CH3COO-+Na+;
故答案为::CH3COONa=CH3COO-+Na+;
(3)一水合氨为弱电解质,部分电离出氨根离子和氢氧根离子,电离方程式为:NH3?H2O
 NH4++OH-;
NH4++OH-;故答案为:NH3?H2O
 NH4++OH-.
NH4++OH-.
点评:本题考查电离方程式的书写知识,明确电解质的强弱是解题关键.注意强电解质在溶液中能完全电离,弱电解质部分电离,离子团在电离方程式中不能拆开,强酸的酸式根离子要拆开,弱酸的酸式根离子不能拆开.

练习册系列答案
 阶梯计算系列答案
阶梯计算系列答案
相关题目
下列不属于四种基本反应类型,但属于氧化还原反应的是( )
| A、Fe+H2SO4=FeSO4+H2↑ |
| B、CO+CuO═Cu+CO2↑ |
| C、Cu2(OH)2CO3═2CuO+H2O+CO2↑ |
| D、4Fe(OH)2+O2+2H2O=4Fe(OH)3 |
下列实验操作合理的是( )
| A、用稀硫酸清洗做焰色反应的铂丝 |
| B、用丁达尔效应鉴别Fe(OH)3胶体和FeCl3溶液 |
| C、用100mL容量瓶配制50mL 0.1 mol?L-1的盐酸 |
| D、测NaOH熔点时可以将NaOH放入石英坩埚中高温熔化 |
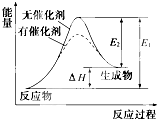 某反应的反应过程中能量变化如图所示(图中E1表示正反应的活化能,E2表示逆反应的活化能).下列有关叙述正确的是( )
某反应的反应过程中能量变化如图所示(图中E1表示正反应的活化能,E2表示逆反应的活化能).下列有关叙述正确的是( )| A、催化剂能改变该反应的焓变 |
| B、催化剂能降低该反应的活化能 |
| C、该反应为放热反应 |
| D、逆反应的活化能大于正反应的活化能 |
关于元素周期表的说法不正确的是( )
| A、元素周期表有7个主族 |
| B、ⅠA族的元素全部是金属元素 |
| C、元素周期表有7个周期 |
| D、短周期是指第一、二、三周期 |
下列反应的离子方程式正确的是 ( )
| A、向沸水中滴加FeCl3溶液制备Fe(OH)3胶体:Fe3++3H2O═Fe(OH)3↓+3H+ |
| B、用小苏打治疗胃酸过多:HCO3-+H+=CO2↑+H2O |
| C、将氯气通入NaOH溶液中制取84消毒液:2Cl2+2OH-=ClO-+3Cl-+H2O |
| D、向Na2O2固体中滴加水:Na2O2+H2O=2Na++2OH-+O2↑ |
常温下,在下列溶液中一定能大量共存的离子组是( )
| A、酸性溶液:Na+、Fe2+、AlO2-、SO42- |
| B、滴加石蕊试剂呈红色的溶液:Na+、Al3+、SO42-、Cl- |
| C、无色透明溶液:MnO4-、SO42-、K+、NO3- |
| D、强碱性的溶液:CO32-、NH4+、Cl-、Ca2+ |