题目内容
【题目】铜的化合物具有广泛的用途。
(1)Cu2+基态核外电子排布式为__________________。
(2)往硫酸铜溶液中加入过量氨水,溶液最终变成深蓝色,继续加入乙醇,可析出![]() N、O、S原子的第一电离能由大到小的顺序为__________________,与SO42-互为等电子体的分子的化学式为__ ,每个乙醇分子中sp3杂化的原子个数为_________________。
N、O、S原子的第一电离能由大到小的顺序为__________________,与SO42-互为等电子体的分子的化学式为__ ,每个乙醇分子中sp3杂化的原子个数为_________________。
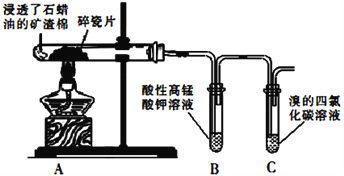
(3)铜的一种氧化物晶体结构如图所示,其中O原子的配位数为_________________。
(4) Cu2O的熔点比Cu2S高的原因是__________________。
【答案】 [Ar]3d9或1s22s22p63s23p63d9 N>O>S CCl4 (CF4、SiF4等合理) 3 4 因为r(O2-)<r(S2-),所以Cu2O的晶格能比Cu2S大,熔点高
【解析】(1)铜的质子数是29,则Cu2+基态核外电子排布式为[Ar]3d9或1s22s22p63s23p63d9。(2)非金属性越强,第一电离能越大,氮元素的2p轨道电子处于半充满状态,稳定性强,第一电离能大于相邻元素,则N、O、S原子的第一电离能由大到小的顺序为N>O>S。原子数和价电子数分别都相等的互为等电子体,则与SO42-互为等电子体的分子的化学式为CCl4、CF4、SiF4等,饱和碳原子均是sp3杂化,羟基氧原子也是sp3杂化,则每个乙醇分子中sp3杂化的原子个数为3个。(3)O原子和铜原子的原子个数分别是8×1/8+6×1/2=4、4,铜原子的配位数是4,则氧原子的配位数也为4;(4)因为r(O2-)<r(S2-),所以Cu2O的晶格能比Cu2S大,熔点高。

 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案【题目】某学生探究如下实验(A):
实验A | 条件 | 现象 |
| 加热 | i.加热后蓝色褪去 ii.冷却过程中,溶液恢复蓝色 ⅲ.一段时间后,蓝色重又褪去 |
(1)使淀粉变蓝的物质是____。
(2)分析现象i、ii认为:在酸性条件下,加热促进淀粉水解,冷却后平衡逆向移动。
设计实验如下,“现象a”证实该分析不合理:

“现象a”是____。
(3)再次分析:加热后单质碘发生了变化,实验如下:
I:取少量碘水,加热至褪色,用淀粉溶液检验挥发出的物质,变蓝。
Ⅱ:向褪色后的溶液中滴加淀粉溶液,冷却过程中一直未变蓝;加入稀H2SO4,瞬间变蓝。
对步骤Ⅱ中稀H2SO4的作用,结合离子方程式,提出一种合理的解释:______________。
(4)探究碘水褪色后溶液的成分:
实验1:测得溶液的pH≈5
实验2:取褪色后的溶液,完成如下实验:

①产生黄色沉淀的离子方程式是____。
②Ag2O的作用是____________。
③依据上述实验,推测滤液中含有的物质(或离子)可能是_________。
(5)结合化学反应速率解释实验A中现象i、现象iii蓝色褪去的原因:_______________。