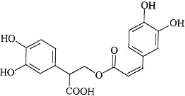
题目内容
【题目】合成氨工业对化学工业和国防工业具有重要意义,对农业生产起着重要作用。
(1)已知:N2(g)+O2(g)=2NO(g) △H1
H2(g)+1/2O2(g)=H2O(1) △H2
4NH3(g)+5O2(g)=4NO(g)+6H2O(1) △H3
N2(g)+3H2(g)2NH3(g) △H4<0
则△H4= (用含△H1、△H2、△H3的代数式表示)。
(2)在其他条件相同时,分别测定合成氨反应中N2的平衡转化率随压强变化的曲线如下图A、B所示,其中正确的是 (填“A”或“B”),其判断理由是 。
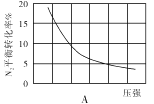
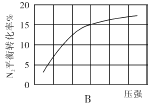
(3)在体积为2L的密闭容器中按物质的量1:3的比例充入N2、H2,进行下列四组合成氨实验:
组别 | 温度 | N2起始量/mol | N2的物质的量/mol | ||||||
5(s) | 10(s) | 15(s) | 20(s) | 25(s) | 30(s) | 35(s) | |||
Ⅰ | T1 | 0.1 | 0.094 | 0.089 | 0.085 | 0.0825 | 0.081 | 0.080 | 0.080 |
Ⅱ | T2 | 0.1 | 0.090 | 0.085 | 0.082 | 0.080 | 0.080 | 0.080 | 0.080 |
Ⅲ | T3 | 0.2 | 0.179 | 0.165 | 0.153 | 0.146 | x | x | x |
Ⅳ | T4 | 0.2 | 0.173 | 0.161 | 0.155 | 0.150 | 0.150 | 0.150 | 0.150 |
①实验Ⅰ前10秒的平均速率v(NH3)= mol·L-1·s-1,T1温度下合成氨反应的平衡常数K= (列出计算式)。
②与实验Ⅰ相比,实验Ⅱ改变了一个条件,该条件可能是 。
③与实验I相比,实验Ⅲ中N2的平衡转化率 (填“增大”、“减小”或“不变”),平衡常数K (填“增大”、“减小”或“不变”)。
④实验Ⅲ与实验Ⅳ的反应条件温度不同,则T1 (填“大于”、“小于”或“等于”)T2,原因是 。
【答案】(1)△H1+3△H2-1/2△H3
(2)B;合成氨反应为气体分子数减小的反应,增大压强,平衡正移,反应物的转化率增大
(3)①0.0011 ![]() (mol·L-1)-2[答出5.79 (mol·L-1)-2也可]
(mol·L-1)-2[答出5.79 (mol·L-1)-2也可]
②加催化剂 ③增大 不变
④小于 T2时的平衡常数小于T1时的平衡常数且正反应放热(或Ⅳ中前10s的平均反应速率比Ⅲ大,N2的平衡转化率比Ⅲ小)
【解析】
试题分析:(1)已知:①N2(g)+O2(g)=2NO(g) △H1
②H2(g)+1/2O2(g)=H2O(1) △H2
③4NH3(g)+5O2(g)=4NO(g)+6H2O(1) △H3
则根据盖斯定律可知①+3×②-0.5×③即得到N2(g)+3H2(g)![]() 2NH3(g)的反应热△H4=△H1+3△H2-1/2△H3。
2NH3(g)的反应热△H4=△H1+3△H2-1/2△H3。
(2)合成氨反应是体积减小的可逆反应,增大压强平衡向正反应方向进行,氮气的转化率增大,则装置图B正确。
(3)①实验Ⅰ前10秒内消耗氮气是0.1mol-0.089mol=0.011mol,则生成氨气是0.022mol,浓度是0.011mol/L,所以平均速率v(NH3)=0.011mol/L÷10s=0.0011mol·L-1·s-1;T1温度下平衡时消耗氮气是0.02mol,同时消耗氢气是0.06mol,生成氨气是0.04mol,则平衡时氮气是0.04mol/L,氢气是0.12mol/L,氨气是0.02mol/L,则合成氨反应的平衡常数K=![]() (mol·L-1)-2。
(mol·L-1)-2。
②与实验Ⅰ相比,实验Ⅱ到达平衡的时间减少,平衡状态不变,则改变的条件可能是使用了催化剂。
③实验Ⅲ中进行到20s时氮气的转化率是![]() ,实验I氮气的平衡转化率是0.2,所以与实验I相比,实验Ⅲ中N2的平衡转化率增大,温度不变,平衡常数K不变。
,实验I氮气的平衡转化率是0.2,所以与实验I相比,实验Ⅲ中N2的平衡转化率增大,温度不变,平衡常数K不变。