题目内容
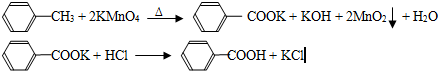
C6H5CH3+2KMnO4
| △ |
C6H5COOK+HCl→C6H5COOH+KCl
实验方法:一定量的甲苯和KMnO4溶液在100℃反应一段时间后停止反应,按如下流程分离出苯甲酸和回收未反应的甲苯.
已知:苯甲酸相对分子质量122,熔点122.4℃,在25℃和95℃时溶解度分别为3g和6.9g;纯净固体有机物一般都有固定熔点.
(1)操作Ⅰ用到的主要实验仪器为

(2)无色液体A是
(3)测定白色固体B的熔点,发现达到130℃时仍有少量不熔.则白色固体B是
(4)纯度测定:称取1.220g产品,配成100mL溶液,移取25.00mL溶液,用KOH溶液发生中和反应,消耗KOH的物质的量为2.40×10-3 mol.产品中苯甲酸质量分数为
(2)依据分离试剂和过程可知,有机相中主要是为反应的甲苯,甲苯是苯的同系物,可以被高锰酸钾溶液氧化;
(3)结合反应化学方程式中生成的产物和流程中分离步骤分析,白色固体B是苯甲酸与KCl的混合物;
(4)苯甲酸是一元弱酸和氢氧化钾1:1反应来解答计算;
故答案为:分液;蒸馏;
(2)依据流程和推断可知,无色液体A为甲苯,检验试剂可以用酸性高锰酸钾溶液,甲苯被氧化为苯甲酸,高锰酸钾溶液紫色褪去;
故答案为:甲苯;酸性KMnO4溶液;
(3)通过测定白色固体B的熔点,达到130℃时仍有少量不熔,推测白色固体B是苯甲酸与KCl的混合物,
故答案为:苯甲酸与KCl;
(4)称取1.220g产品,配成100mL溶液,移取25.00ml溶液,滴定,消耗KOH的物质的量为2.40×10-3mol,苯甲酸是一元弱酸和氢氧化钾1:1反应,25.00ml溶液中含有2.40×10-3mol苯甲酸,100mL溶液溶液中含有9.6×10-3mol苯甲酸,则样品中苯甲酸质量分数
| 9.6×10-3mol×122g/mol |
| 1.22g |
故答案为:96%;

 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案苯甲酸广泛应用于制药和化工行业。某化学小组用甲苯作主要原料制备苯甲酸,反应过程如下:

甲苯、苯甲酸钾、苯甲酸的部分物理性质见下表:
|
物质 |
熔点/℃ |
沸点/℃ |
密度/g·cm-3 |
在水中溶解性 |
|
甲苯 |
-95 |
110.6 |
0.8669 |
难溶 |
|
苯甲酸钾 |
121.5~123.5 |
|
|
易溶 |
|
苯甲酸 |
122.4 |
248 |
1.2659 |
微溶 |
(1)将步骤①得到混合物加少量水,分离有机相和水相。有机相在 (填“上”或“下”)层;实验操作的名称是 。
(2)步骤②用浓盐酸酸化的目的是 。
(3)减压过滤装置所包含的仪器除减压系统外,还有 、 (填仪器名称)。
(4)已知温度越低苯甲酸的溶解度越小,但为了得到更多的苯甲酸晶体,重结晶时并非温度越低越好,理由是 。
(5)重结晶时需要趁热过滤,目的是 。
苯甲酸广泛应用于制药和化工行业,某同学尝试用甲苯的氧化反应制备苯甲酸,反应原理:
![]()
![]()
![]() CH3 + 2KMnO4 Δ COOK + KOH + 2MnO2 + H2O
CH3 + 2KMnO4 Δ COOK + KOH + 2MnO2 + H2O
![]()
![]()
![]() COOK + HCl COOH + KCl
COOK + HCl COOH + KCl
|
|
|
|
|
|
|
|
| |||||
|
|
已知:苯甲酸分子量122,熔点122.4℃,在25℃和95℃时溶解度分别为0.3 g和6.9 g;纯净固体有机物都有固定熔点。
(1)操作Ⅰ为 ,操作Ⅱ为 。
(2)无色液体A是 ,定性检验A的试剂是 ,现象是
。
(3)测定白色固体B的熔点,发现其在115℃开始熔化,达到130℃时仍有少量不熔,该同学推测白色固体B是苯甲酸与KCl的混合物,设计了如下方案进行提纯和检验,实验结果表明推测正确。请在答题卡上完成表中内容。
| 序号 | 实验方案 | 实验现象 | 结论 |
| ① | 将白色固体B加入水中,加热溶解,
| 得到白色晶体和无色溶液 | |
| ② | 取少量滤液于试管中, | 生成白色沉淀 | 滤液含Cl— |
| ③ | 干燥白色晶体, |
| 白色晶体是苯甲酸 |
(4)纯度测定:称取1.220g产品,配成100ml甲醇溶液,移取25.00ml溶液,滴定,消耗KOH的物质的量为2.40×10—3mol,产品中苯甲酸质量分数的计算表达式为 ,计算结果为 (保留二位有效数字)。