题目内容
8.A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸.
(1)分别写出B、C装置中铁片表面发生的电极反应:
B:Fe-2e-=Fe2+
C:2H++2e-=H2↑
(2)A、B、C中铁被腐蚀的速率,由快到慢的顺序是B>A>C
(3)科学工作者为心脏病人设计的心脏起搏器的电池是以Pt和Zn为电极材料,依靠人体内液体中含有一定浓度的溶解氧、H+和Zn2+进行工作.该电池的正极反应:O2+4H++4e-═2H2O.
分析 (1)金属铁和硫酸能发生置换反应,Sn、Fe、硫酸构成的原电池中,金属铁较活泼,做负极,Zn、Fe、硫酸构成的原电池中,金属锌较活泼,做负极;
(2)电化学腐蚀的速率大于化学腐蚀的速率,金属做原电池正极时得到保护;
(3)氧气在正极发生还原反应,电极反应式为:O2+4H++4e-═2H2O.
解答 解:(1)A中是金属铁和硫酸能发生置换反应,原理方程式为:Fe+2H+=Fe2++H2↑;B中Sn、Fe、硫酸构成的原电池,金属铁较活泼,做负极,电极反应为:Fe-2e-=Fe2+,C中,Zn、Fe、硫酸构成的原电池,金属锌较活泼,做负极,金属铁作正极,该极发生的电极反应为:2H++2e-=H2↑,故答案为:Fe-2e-=Fe2+;2H++2e-=H2↑;
(2)A发生化学腐蚀,B发生电化学腐蚀,C锌比铁活泼,铁做原电池的正极而被保护,电化学腐蚀的速率大于化学腐蚀的速率,铁被腐蚀的速率由快到慢的顺序是B>A>C,故答案为:B>A>C;
(3)氧气在正极发生还原反应,电极反应式为:O2+4H++4e-═2H2O,故答案为:O2+4H++4e-═2H2O.
点评 本题考查原电池的概念和工作原理知识,可以根据所学知识进行回答,难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
19.霉酚酸酯(MMF)是器官移植中抑制细胞增殖最常用的药物,它在酸性溶液中能发生如下反应:
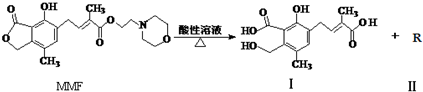
下列说法中正确的是( )

下列说法中正确的是( )
| A. | 1molMMF与足量NaOH 溶液共热,最多可消耗5molNaOH | |
| B. | 可以用NaHCO3溶液区别MMF与化合物Ⅰ | |
| C. | 化合物 R的分子式为C6H13NO2 | |
| D. | 一个MMF分子中含有2个手性碳原子 |
16.下列叙述错误的是( )
| A. | 把aL0.1mol/L 的CH3COOH溶液与bL0.1mol/L的 KOH溶液混合,所得溶液中一定存在:c(K+)+c(H+)=c(CH3COO-)+c(OH-) | |
| B. | 把0.1mol/L 的NaHCO3溶液与0.3mol/L 的Ba(OH)2溶液等体积混合,所得溶液中一定存在:c(OH-)>c(Ba+)>c(Na+)>c(H+) | |
| C. | 向1mol/L 的CH3COOH溶液中加入少量CH3COONa固体,由于CH3COONa水解显碱性,所以溶液的pH升高 | |
| D. | 常温下,在pH=3的CH3COOH溶液和pH=11的NaOH溶液中,水的电离程度相同 |
13.一定条件下,反应2SO2+O2?2SO3在密闭容器中进行.下列关于该反应的说法不正确的是( )
| A. | 升高温度能加快反应速率 | |
| B. | 增大SO2的浓度能加快反应速率 | |
| C. | 加入道量的O2可使SO2的转化率达到100% | |
| D. | 使用恰当的催化剂能加快反应速率 |
20.下列各组中,互为同素异形体的是( )
| A. | 12H2和13H2 | B. | H2O与H2O2 | C. | 金刚石和石墨 | D. | 碘晶体和碘蒸气 |
17.“西气东输”是我国为改善东部地区能源紧缺、开发大西北而实施的一项重大工程.这里的“气”是指( )
| A. | 氢气 | B. | 天然气 | C. | 一氧化碳 | D. | 水煤气 |
18.下列物质能用铝制器皿盛放的是( )
| A. | 稀硝酸 | B. | 稀硫酸 | C. | 浓硝酸 | D. | 浓盐酸 |
 2001年诺贝尔化学奖被美国的诺尔斯、夏普雷斯和日本的野依良治获得,他们发现了某些手性化子可用作某些化学反应的催化剂,为合成对人类有用的重要化合物开辟了一个全新的研究领域.
2001年诺贝尔化学奖被美国的诺尔斯、夏普雷斯和日本的野依良治获得,他们发现了某些手性化子可用作某些化学反应的催化剂,为合成对人类有用的重要化合物开辟了一个全新的研究领域. 、
、 .
. ②
② ③
③
 .
. .
.
 .
. .
. .
.