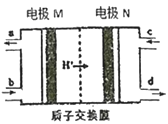
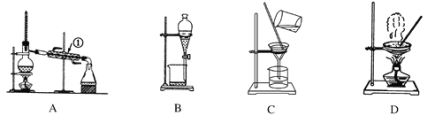
题目内容
【题目】下列有关实验装置进行的相应实验,不能达到实验目的的是



A. 用图①所示装置制取少量纯净的CO2气体
B. 用图②所示装置验证镁和盐酸反应的热效应
C. 用图③所示装置验证HCl气体易溶于水
D. 用图④所示装置检验NH4Cl分解产生的气体
【答案】A
【解析】
A.该装置适用于块状且难溶的固体与液体反应产生气体的类型,因纯碱易溶于水,故A不能达目的;
B.若U形管中红墨水左低右高则可说明镁和盐酸反应为放热反应,故B能达实验目的;
C.HCl极易溶于水,挤压胶头滴管,气球变大,则装置③可验证HCl气体易溶于水,故C能达目的;
D.NH4Cl分解生成氨气、HCl,氨气可使酚酞试纸变蓝,HCl可使湿润的蓝色石蕊试纸变红,五氧化二磷、碱石灰均可除杂,则装置④可检验NH4Cl分解产生的气体,故D能达目的;
答案选A。

【题目】在2 L的恒容密闭容器中充入A(g)和B(g),发生反应A(g)+B(g)![]() 2C(g)+D(s) △H=a kJ·mol-1,实验内容和结果分别如表和图所示,下列说法不正确的是
2C(g)+D(s) △H=a kJ·mol-1,实验内容和结果分别如表和图所示,下列说法不正确的是
实验序号 | 温度 | 起始物质的量 | 热量变化 | |
A | B | |||
I | 600℃ | 1mol | 3mol | 96kJ |
II | 800℃ | 1.5mol | 0.5mol | —— |
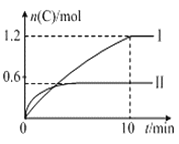
A. 实验Ⅰ中,10 min内平均速率v(B)=0.03 mol·L-1·min-1
B. 上述方程式中a=160
C. 600 ℃时,该反应的平衡常数是1.5
D. 向实验Ⅱ的平衡体系中再充入0.5 mol A和1.5 mol B,A的转化率增大
【题目】如何降低大气中CO2的含量及有效地开发利用CO2是当前科学家研究的重要课题。
(1)科学家用H2和CO2生产甲醇燃料。为探究该反应原理,进行如下实验:某温度下,在容积为2 L的密闭容器中充入1 mol CO2和3.25 mol H2,在温度一定的条件下反应,测得CO2、CH3OH(g)和H2O(g)的物质的量(n)随时间的变化关系如图所示。
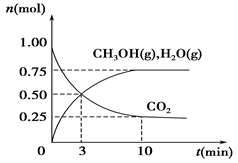
①从反应开始到3 min时,氢气的平均反应速率v(H2)=________。
②下列措施中一定能使CO2的转化率增大的是________。
A.在原容器中再充入1 mol CO2 B.在原容器中再充入1 mol H2
C.在原容器中充入1 mol He D.使用更有效的催化剂
E.缩小容器的容积 F.将水蒸气从体系中分离出
③能说明反应已达平衡状态的是________(填字母,下同)。
A.v(H2)=3v(CO2) B.容器内压强保持不变
C.v逆(CO2)=v正(CH3OH) D.容器内密度保持不变
(2)科学家还利用氢气在一定条件下与二氧化碳反应生成乙醇燃料,其热化学反应方程式为2CO2(g)+6H2(g) ![]() CH3CH2OH(g)+3H2O(g) ΔH=a kJ·mol-1,在一定压强下,测得该反应的实验数据如表所示。请根据表中数据回答下列问题。
CH3CH2OH(g)+3H2O(g) ΔH=a kJ·mol-1,在一定压强下,测得该反应的实验数据如表所示。请根据表中数据回答下列问题。
n(H2)/n(CO2) | 500 | 600 | 700 | 800 |
1.5 | 45 | 33 | 20 | 12 |
2 | 60 | 43 | 28 | 15 |
3 | 83 | 62 | 37 | 22 |
①上述反应的a________0(填“大于”或“小于”)。
②恒温下,向反应体系中加入固体催化剂,则反应产生的热量________(填“增大”“减小”或“不变”)。
③增大![]() 的值,则生成乙醇的物质的量________(填“增大”“减小”“不变”或“不能确定”)。
的值,则生成乙醇的物质的量________(填“增大”“减小”“不变”或“不能确定”)。