题目内容
【题目】下列离子方程式正确的是
A. 钢铁腐蚀的负极反应:Fe – 3e- === Fe3+
B. HCO![]() 的水解:HCO
的水解:HCO![]() +H2O
+H2O![]() CO32-+H3O+
CO32-+H3O+
C. 用惰性电极电解饱和食盐水: 2Cl–+2H2O![]() H2↑+ Cl2↑+2OH–
H2↑+ Cl2↑+2OH–
D. AgCl悬浊液中加入KI溶液得到黄色沉淀:Ag+ + I- === AgI↓
【答案】C
【解析】A.铁失去电子变为亚铁离子;B.碳酸氢根离子水解生成碳酸和氢氧根离子;
C.用惰性电极电解饱和食盐水,阴极得到氢气,阳极得到氯气,正确的离子方程式为:2Cl–+2H2O![]() H2↑+ Cl2↑+2OH–;D.氯化银难溶,不能拆,保留分子形式。
H2↑+ Cl2↑+2OH–;D.氯化银难溶,不能拆,保留分子形式。
详解:A.钢铁发生电化学腐蚀的负极反应为Fe – 2e- === Fe2+,故A错误;
B.碳酸氢钠溶于水溶液呈碱性的离子反应为HCO![]() +H2O
+H2O![]() H2CO3+OH-,故B错误;
H2CO3+OH-,故B错误;
C.用惰性电极电解饱和食盐水,阴极得到氢气,阳极得到氯气,正确的离子方程式为:2Cl–+2H2O![]() H2↑+ Cl2↑+2OH–,故C正确;
H2↑+ Cl2↑+2OH–,故C正确;
D.氯化银难溶,不能拆,保留分子形式。故D错误;
因此,本题选C。

 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案【题目】下表物质与其所含化学键类型、所属化合物类型完全正确的一组是( )
选项 | A | B | C | D |
物质 | CO2 | MgCl2 | HCl | NaOH |
所含化学键类型 | 共价键 | 离子键、共价键 | 离子键 | 离子键、共价键 |
所属化合物类型 | 共价化合物 | 离子化合物 | 离子化合物 | 共价化合物 |
A.AB.BC.CD.D
【题目】根据下列实验操作和现象所得到的结论正确的是
选项 | 实验操作和现象 | 结论 |
A | 在0.1 molL-1Na2CO3溶液中,滴加2滴酚酞显浅红色,微热,红色加深 | CO32-水解是吸热反应 |
B | 等体积、pH=3的两种酸HA和HB分别与足量的Zn反应,酸HA放出的氢气多 | 酸性A比B强 |
C | 常温下,用饱和Na2CO3溶液可将BaSO4部分转化为BaCO3 | Ksp(BaSO4)>Ksp(BaCO3) |
D | 室温下,用pH试纸测得:0.1 molL-1 Na2SO3溶液的pH约为10;0.1 molL-1 NaHSO3溶液的pH约为5 | HSO |
A. A B. B C. C D. D
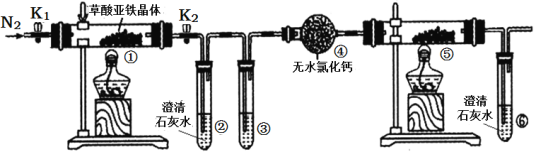
【题目】工业上用粗制的氧化铜粉末(含杂质Fe和SiO2)来制取无水CuCl2的工艺流程如图所示:
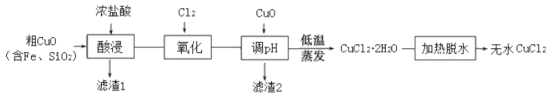
(1)“酸浸”时发生的复分解反应化学方程式为:____。为加快酸浸速率可以采取的措施是:____(任举一条)。
(2)“氧化”时发生的离子方程式为:_____。
(3)下表列出了相关金属离子生成氢氧化物沉淀的pH。“调pH”时应控制溶液pH范围为_____。
金属离子 | 开始沉淀的pH | 沉淀完全的pH |
Fe3+ | 1. 5 | 3. 7 |
Cu2+ | 4.2 | 6. 4 |
Fe2+ | 6.5 | 9.7 |
当pH=4时,溶液中c(Fe3+)=____。已知:Ksp[Fe(OH)3]=2.6×10―39
(4)“加热脱水”需要提供的条件为:_____。
【题目】用下图装置(夹持、加热装置已略)进行实验,有②中现象,不能证实①中反应发生的是( )
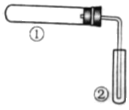
①中实验 | ②中现象 | |
A | 铁粉与水蒸气加热 | 肥皂水冒泡 |
B | 加热NH4Cl和Ca(OH)2混合物 | 酚酞溶液变红 |
C | NaHCO3固体受热分解 | 澄清石灰水变浑浊 |
D | 石蜡油在碎瓷片上受热分解 | Br2的CCl4溶液褪色 |