题目内容
【题目】锡及其化合物在生产、生活中有着重要的用途。已知:Sn的熔点为231℃;Sn2+易水解、易被氧化;SnCl4极易水解、熔点为-33 ℃、沸点为114 ℃。请按要求回答下列相关问题:
(1)锡在周期表中的位置为_____________.
(2)用于镀锡工业的硫酸亚锡(SnSO4)的制备步骤如下:
I.SnCl2加入盐酸和Sn 粉
II.分离滤渣和滤液
Ⅲ.滤液用NaHCO3调节pH至6~7 得混合物(含SnO)
Ⅳ.从混合物中分离得SnO
V.SnO和稀硫酸最终得SnSO4晶体
①步骤Ⅰ加入Sn粉的作用: _________________及调节溶液pH。
②步骤Ⅱ用到的玻璃仪器有烧杯、_______________、______________。
③步骤Ⅲ生成SnO的离子方程式:_________________________。
④步骤Ⅳ中检验SnO是否洗涤干净的操作是_____________________,证明已洗净。
⑤步骤Ⅴ操作依次为 _____________、____________、过滤、洗涤、低温干燥。
(3)SnCl4蒸气遇氨及水汽呈浓烟状,因而可制作烟幕弹,其反应的化学方程式为__________________。
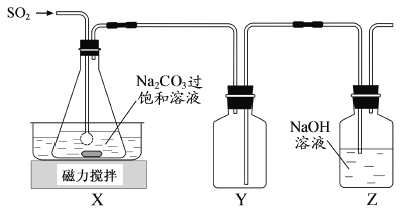
实验室欲用下图装置制备少量SnCl4(夹持装置略),该装置存在明显缺陷,改进方法是__________。
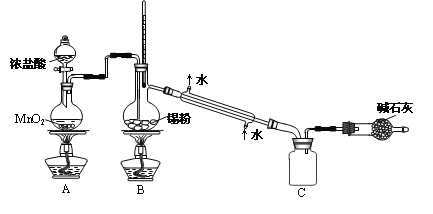
(4)利用改进后的装置进行实验,当开始装置C中收集到有SnCl4时即可熄灭B处酒精灯,反应仍可持续进行的理由是_________________。
(5)用于微电子器件生产的锡粉纯度测定:
①取2.38g试样溶于较浓硫酸中(杂质不参与反应),使Sn完全转化为Sn2+;
②加入过量的Fe2(SO4)3;
③用0.1000mol/LK2Cr2O7溶液滴定,消耗20.00mL。步骤②中加入Fe2(SO4)3的作用是:__________;此锡粉样品中锡的质量分数:____________。
【答案】(1)第五周期IVA族;
(2)①防止Sn2+被氧化为Sn4+;
②漏斗(或普通漏斗)、玻璃棒;
③Sn2++2HCO3-=SnO+2CO2↑+H2O;
④取最后一次洗涤后滤液少许于试管中,依次滴加足量硝酸、少量硝酸银溶液,观察到无白色沉淀;
⑤蒸发浓缩、冷却结晶;
(3)SnCl4+4NH3+4H2O=Sn(OH)4+4NH4Cl;在A、B装置间依次连接盛有饱和食盐水、浓硫酸的洗气瓶;
(4)熔融锡与氯气化合的反应是放热反应,且放出的热足够使此反应持续进行;
(5)将Sn2+全部氧化为Sn4+;30%;
【解析】试题分析:(1)锡是碳族元素,位于周期表的第五周期IVA族,故答案为:第五周期IVA族;
(2)由于Sn2+易水解、易被氧化,加入盐酸,抑制Sn2+水解,加入Sn粉可以与盐酸反应,调节溶液pH,还防止Sn2+被氧化,步骤Ⅱ为过滤,得SnCl2溶液,向其中加碳酸氢钠,调节溶液pH,使Mn元素以SnO形式沉淀,再过滤洗涤得纯净的SnO,加稀硫酸,得SnSO4溶液,加热浓缩、冷却结晶、过滤、洗涤,制得SnSO4晶体,滤液D中含有大量的NaCl等.
①由信息可知,Sn2+易被氧化,加入Sn粉除调节溶液pH外,还防止Sn2+被氧化; 故答案为:防止Sn2+被氧化;
②步骤Ⅱ是过滤,用到的玻璃仪器除烧杯外,还有漏斗、玻璃棒,故答案为:漏斗、玻璃棒;
③得到沉淀是SnO,Sn元素化合价为变化,属于非氧化还原反应,变质发生水解反应生成Sn(OH)2与二氧化碳,Sn(OH)2再脱水得到SnO,反应离子方程为:Sn2++2HCO3-=SnO↓+2CO2↑+H2O,故答案为:Sn2++2HCO3-=SnO↓+2CO2↑+H2O;
④沉淀为SnO表面附着着Cl-,要想检验滤渣是否洗涤干净,用硝酸、硝酸银溶液检验最后一次洗涤液中是否含有Cl-,具体方案为:取最后一次滤液少许于试管中,依次滴加足量硝酸、少量硝酸银溶液,观察到无白色沉淀,说明洗涤干净,故答案为:取最后一次滤液少许于试管中,依次滴加足量硝酸、少量硝酸银溶液,观察到无白色沉淀;
⑤由流程图可知,操作V是从溶液中得到含结晶水的晶体,只能采取蒸发浓缩、冷却结晶、过滤、洗涤得到,故答案为:蒸发浓缩、冷却结晶;
(3)SnCl4水解得到Sn(OH)4与HCl,HCl与氨气反应得到NH4Cl,反应方程式为:SnCl4+4NH3+4H2O=Sn(OH)4+4NH4Cl;
由于SnCl4易水解,制备中应在干燥环境中进行,制备的氯气中含有HCl、水蒸气,需要除去,防止Sn与HCl反应,SnCl4水解,改进方法是:在A、B装置间依次连接盛有饱和食盐水、浓硫酸的洗气瓶;故答案为:SnCl4+4NH3+4H2O=Sn(OH)4+4NH4Cl;在A、B装置间依次连接盛有饱和食盐水、浓硫酸的洗气瓶;
(4)熔融锡与氯气化合的反应是放热反应,且放出的热足够使此反应持续进行,故答案为:熔融锡与氯气化合的反应是放热反应,且放出的热足够使此反应持续进行;
(5)Fe2(SO4)3将Sn2+全部氧化为Sn4+,再用溶液K2Cr2O7溶液滴定,将Fe2+氧化为Fe3+,
设粉中锡的质量分数为x,则:
3Sn~3Sn2+~6Fe3+~6Fe2+~K2Cr2O7
3×119g 1mol
2.38g×x 0.100mol/L×0.02L
故3×119g:2.38g×x=1mol:0.100mol/L×0.02L,
解得x=30%,故答案为:将Sn2+全部氧化为Sn4+;30%.