��Ŀ����
����Ŀ���������ȣ�ClO2��Ϊһ�ֻ���ɫ���壬�ǹ����Ϲ��ϵĸ�Ч�����ס����١���ȫ��ɱ����������Ŀǰ�ѿ������õ�ⷨ��ȡClO2���¹��գ�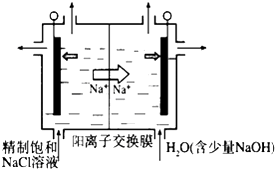
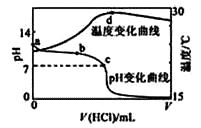
��1������ͼʾ����ʯī���缫����һ�������µ�ⱥ��ʳ��ˮ��ȡClO2��д����������ClO2�ĵ缫��Ӧʽ�� ��
�ڵ��һ��ʱ�䣬�������������������Ϊ112mL����״����ʱ��ֹͣ��⣮ͨ�������ӽ���Ĥ�������ӵ����ʵ���Ϊmol����ƽ���ƶ�ԭ������������pH�����ԭ����
��2��ClO2����ˮ��Fe2+��Mn2+��S2-��CN-�������Ե�ȥ��Ч����ij������ˮ�к�CN-amg/L������ClO2��CN-������ֻ�����������壬�����ӷ�Ӧ����ʽΪ������100m3������ˮ��������ҪClO2mol��
��3��Ϊ��״�ȼ�ϵ������ʣ���ѧ�ҷ�����һ��ȼ�ϵ�أ���ص�һ���缫ͨ���������һ���缫ͨ��״����壬������Dz�����Y2O3��ZrO2���壬�ڸ��������ܴ���O2������ع���ʱ������ӦʽΪ��
���𰸡�
��1��Cl- - 5e- + 2H2O = ClO2��+ 4H+��0.01������������2H+ + 2e- =H2����H+Ũ�ȼ�С��ʹ��H2O ![]() OH-+H+��ƽ�������ƶ���OH-Ũ������pH����
OH-+H+��ƽ�������ƶ���OH-Ũ������pH����
��2��2ClO2+2CN- = N2��+ 2CO2��+2Cl��- ![]() ����3.85a��
����3.85a��
��3��O2+4e-=2O2-
��������(1)����������������Ӧ���������֪�������ӷŵ�����ClO2 �� ��Ԫ���غ��֪����ˮ�μӷ�Ӧ����ϵ���غ��֪��ͬʱ���������ӣ������缫��ӦʽΪ��Cl--5e-+2H2O=ClO2��+4H+��
������������2H++2e-=H2�������������ʵ���Ϊ ![]() =0.005mol��ͨ�������ӽ���Ĥ��������Ϊ+1�����ӣ��ʽ���Ĥ�������ӵ����ʵ���Ϊ0.005mol��2=0.01mol�����������H+Ũ�ȼ�С��ʹ��H2O
=0.005mol��ͨ�������ӽ���Ĥ��������Ϊ+1�����ӣ��ʽ���Ĥ�������ӵ����ʵ���Ϊ0.005mol��2=0.01mol�����������H+Ũ�ȼ�С��ʹ��H2O ![]() OH-+H+��ƽ�������ƶ�����Һ��pH����
OH-+H+��ƽ�������ƶ�����Һ��pH����
(2)ClO2��CN-������ֻ�����������壬Ӧ���ɵ����������̼��ͬʱ���������ӣ���Ӧ���ӷ���ʽΪ��2ClO2+2CN-=N2��+2CO2��+2Cl- �� 100m3��ˮ��CN-����=100m3��ag/m3=100ag��CN-�����ʵ���Ϊ ![]() =
= ![]() mol���ɷ���ʽ��֪��������ҪClO2�����ʵ���=
mol���ɷ���ʽ��֪��������ҪClO2�����ʵ���= ![]() mol��
mol��![]()
(3)ȼ�ϵ�أ���ص�һ���缫ͨ ���������һ���缫ͨ��״����壬������Dz����� Y2O3��ZrO2���壬�ڸ��������ܴ���O2-���ӣ�����ԭ���ԭ��������O2�õ��������ɸ���O2-��O2+4e-=2O2-��
�ʴ�Ϊ����1����Cl--5e-+2H2O=ClO2��+4H+����0.01������������2H++2e-=H2����H+Ũ�ȼ�С��ʹ��H2O OH-+H+��ƽ�������ƶ���OH-Ũ������pH����2��2ClO2+2CN-=N2��+2CO2��+2Cl-��![]() ����3��O2+4e-=2O2-
����3��O2+4e-=2O2-
��1��������������ClO2��Ҫ����Һ�е�Cl-ʧȥ���Ӻ�����ģ���ϵ���غ㡢ԭ���غ���д�缫��Ӧʽ��
������������Ӧ��2H++2e-=H2������������������������������ת�Ƶ������ӣ���ϻ���ƽ���ƶ�������
��2����ClO2��CN-������ֻ�����������壬˵������������ΪCO2��N2 �� �ݴ�д����Ӧ�����ӷ���ʽ�����ݷ���ʽ������ҪClO2�����ʵ�����
��3���������������ʣ����ڴ��������ӣ�������Ӧ�������õ��ӱ�������ӣ�

 ȫ��������ϵ�д�
ȫ��������ϵ�д� һ��һ����ʱ���ϵ�д�
һ��һ����ʱ���ϵ�д�����Ŀ������������ʵ�����������õ���Ⱥ͵���ƽ�ⳣ����ʾ���±��dz����¼���������ʵĵ���ƽ�ⳣ����
���� | ���볣��(Ka��Kb) | �ѣ������� | �ܶȻ�������Ksp�� |
CH3COOH | 1��8��10��5 | BaSO4 | 1��10-10 |
HNO2 | 4��6��10��4 | BaCO3 | 2.6��10-9 |
HCN | 5��10��10 | CaSO4 | 7��10-5 |
HClO | 3��10��8 | CaCO3 | 5��10-9 |
NH3��H2O | 1��8��10��5 |
��ش��������⣺
��1�������������У������������� (�û�ѧʽ��ʾ)��������ʹ������Һ��CH3COOH�ĵ���̶��������볣������IJ�����(�����)��
A�������¶� B����ˮϡ��
C����������CH3COONa���� D��������������
��2��CH3COONH4��ˮ��Һ�� (ѡ����ԡ������ԡ����ԡ�)�������� �� ��Һ�и�����Ũ�ȴ�С�Ĺ�ϵ����
��3�����ʵ���1��1��NaCN��HCN�Ļ����Һ����pH��7������Һ�����ӵ�Ũ�ȴӴ�С����Ϊ��
��4����ҵ�г���BaSO4ת��ΪBaCO3���ٽ����Ƴɸ��ֿ����Եı��Σ��磺BaCl2���������������ñ��͵Ĵ�����Һ����BaSO4��ĩ�������ϲ��䴿����BaSO4ת��ΪBaCO3������������BaSO4����Һ���ڸ�����Һ�мӴ����ĩ�����Ͻ��裬ΪʹSO42-���ʵ���Ũ�ȴﵽ0.01mol��L-1���ϣ�����Һ��CO32-���ʵ���Ũ��Ӧ ��mol��L-1��
����Ŀ����֪��I2+2S2O32-=S4O62-+2I-
������ʵ��ܶȻ��������±���
���� | Cu(OH)2��ɫ | Fe(OH)3��� | CuCl��ɫ | CuI��ɫ |
Ksp | 2.2��10-20 | 2.6��10-39 | 1.02��10-6 | 1.3��10-12 |
��1��ij����CuCl2��Һ�к���������FeCl3 �� Ϊ�õ�������CuCl2��2H2O���壬���� �� ����pH=4��ʹ��Һ�е�Fe3+ת��ΪFe(OH)3��������ʱ��Һ�е�c(Fe3+)=�����˺�������Һ����������Ũ���ᾧ���ɵõ�CuCl2��2H2O���塣
��2���ڿ�����ֱ�Ӽ���CuCl2��2H2O����ò���������ˮCuCl2 �� ԭ����(�û�ѧ����ʽ��ʾ)����CuCl2��2H2O����õ�������ˮCuCl2�ĺ�����������
��3��ijѧϰС���á���ӵ��������ⶨ����CuCl2��2H2O���������(��������I-������Ӧ������������)�Ĵ��ȣ��������£�ȡ0.36 g��������ˮ���������KI���壬��ַ�Ӧ�����ɰ�ɫ��������0.100 0 mol��L-1 Na2S2O3����Һ�ζ�������ζ��յ�ʱ������Na2S2O3����Һ20.00 mL��
��ѡ�����ζ�ָʾ�����ζ��յ����������
CuCl2��Һ��KI��Ӧ�����ӷ���ʽΪ��