题目内容
在恒温恒容容器中进行反应A(g) 2B(g)+C(g),若A的浓度由0.1 mol·L
2B(g)+C(g),若A的浓度由0.1 mol·L 降到0.06 mol·L
降到0.06 mol·L 需20 s,那么由0.06 mol·L
需20 s,那么由0.06 mol·L 降到0.024 mol·L
降到0.024 mol·L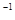 需要的时间
需要的时间
A.等于18s B,等于12s C,小于18s D.大于18s
D
解析试题分析:前20s的平均速率是(0.1-0.06) mol·L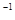 /20s=0.002 mol·L
/20s=0.002 mol·L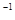 ·s
·s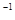 。按这种平均速率计算,0.06 mol·L
。按这种平均速率计算,0.06 mol·L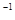 降到0.024 mol·L
降到0.024 mol·L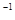 需要的时间(0/06-0.024) mol·L
需要的时间(0/06-0.024) mol·L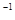 /0.002 mol·L
/0.002 mol·L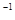 ·s
·s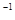 =18s,由于反应的进行,A的浓度越来越小,故所需时间要大于18s。
=18s,由于反应的进行,A的浓度越来越小,故所需时间要大于18s。
考点:化学反应时间的计算。

某化学反应中,反应物B的物质的量浓度在20s内,从2.0mol/L变成了1.0mol/L,则这20s内B的反应速率为
A.0.05mol/(L s) s) | B.0.05 | C.0.5mol/(L s) s) | D.0.05mol/L |
下列过程中,需要增大化学反应速率的是( )
| A.钢铁腐蚀 | B.食物腐败 | C.塑料老化 | D.工业合成氨 |
在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图所示,则下列说法正确的是 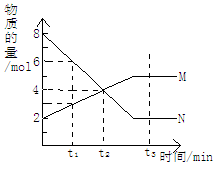
A.反应的化学方程式为:2M N N |
| B.t2时,正逆反应速率相等,达到平衡 |
| C.t3时,正反应速率大于逆反应速率 |
| D.t1时,N的浓度是M浓度的2倍 |
用铁片与2mol/L稀硫酸反应制取氢气时,下列措施不能使反应速率加快的是
| A.滴加NaCl溶液 | B.加热 |
| C.换用4mol/L硫酸 | D.换用铁粉 |
对于300mL 1 mol·L-1盐酸与铁片的反应,采取下列措施:
①升高温度 ②改用100mL 3 mol·L-1盐酸
③再加300mL 1 mol·L-1盐酸 ④用等量铁粉代替铁片 ⑤改用100mL 98%的硫酸
其中能使反应速率加快的是
| A.①②④ | B.①③④ | C.①②③④ | D.①②③⑤ |
把下列4种Na2S2O3溶液和相应体积的水,分别加入4个盛有20 mL 2 mol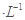 硫酸的烧杯中,此时,Na2S2O3和H2SO4缓慢地进行反应:
硫酸的烧杯中,此时,Na2S2O3和H2SO4缓慢地进行反应: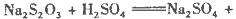
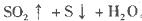 其中最早出现明显浑浊的是
其中最早出现明显浑浊的是
A.25  .20 mL 3 mol .20 mL 3 mol 的Na2S2O3溶液,25 mL蒸馏水 的Na2S2O3溶液,25 mL蒸馏水 |
B.0  .30 mL 2 mol .30 mL 2 mol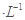 的Na2S2O3溶液,15 mL蒸馏水 的Na2S2O3溶液,15 mL蒸馏水 |
C.25 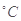 .10 mL 4 mol .10 mL 4 mol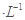 的Na2S2O3溶液,35 mL蒸馏水 的Na2S2O3溶液,35 mL蒸馏水 |
D.0 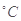 .10 mL 2mol .10 mL 2mol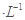 的Na2S2O3溶液,35 mL蒸馏水 的Na2S2O3溶液,35 mL蒸馏水 |
可以充分说明反应P(g)+Q(g) R(g)+S(g)在恒温下已达到平衡的是( )
R(g)+S(g)在恒温下已达到平衡的是( )
| A.反应容器内的压强不随时间改变 | B.反应容器内P、Q、R、S四者共存 |
| C.P的生成速率和S的生成速率相等 | D.反应容器内的气体总物质的量不随时间变化 |