题目内容
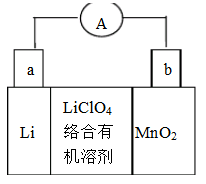
(10分)下图是一个化学过程的示意图。
(1)图中乙池是 装置。
(2)c(Pt)电极的名称是 。
(3)写出通入CH3OH的电极的电极反应式是 。
(4)乙池中反应的离子方程式为 。
(5)当乙池中B(Ag)极的质量增加5.40g时,甲池中理论上消耗O2 mL(标准状况下);此时丙池某电极析出1.6g某金属,则丙中的某盐溶液可能是 (填序号)
| A.MgSO4 | B.CuSO4 | C.NaCL | D.AgNO3 |
(10分)
(1)电解池 (1分)
(2) 阳极(1分)
(3)CH3OH+8OH--6 e- CO32-+6H2O(2分)
(4) 4Ag++2H2O 4Ag+O2↑+4H+(2分)
4Ag+O2↑+4H+(2分)
(5)280 (2分) B(2分)
解析试题分析:(1)由图可知甲池能自发发生氧化还原反应,是燃料电池,乙、丙都是电解池装置;
(2)甲池通入甲醇的一极是负极,氧气一极是正极,d与负极相连,所以d是阴极,则c是阳极;
(3)通入甲醇的一极是负极发生氧化反应,失去电子生成二氧化碳,二氧化碳与电解质溶液反应,最终生成碳酸根离子和水,电极反应式为CH3OH+8OH--6 e- CO32-+6H2O;
(4)乙是电解硝酸银溶液,A是阳极,B是阴极,所以阳极产生氧气,阴极产生Ag,离子方程式为4Ag++2H2O 4Ag+O2↑+4H+;
4Ag+O2↑+4H+;
(5)乙中B增加的质量是析出的Ag的质量,所以析出5.4gAg时转移电子的物质的量是5.4g/108g/mol=0.05mol,根据反应O2+4e-+2H2O=4OH-,可知甲池中理论消耗氧气得物质的量是0.05/4mol,标准状况下的体积是0.05/4mol×22.4L/mol=0.28L=280mL;丙池析出金属0.64g,丙池转移电子的物质的量也是0.05mol,若该金属是+1价,则该金属的相对原子质量是1.6/0.05=32,若该金属是+2价金属,则该金属的相对原子质量是1.6/0.05/2=64,所以答案选B。
考点:考查原电池、电解池的判断,电化学原理的应用

 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
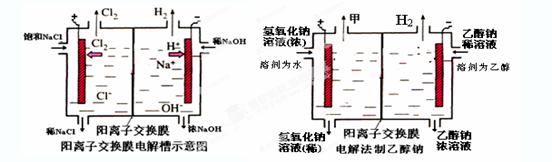
三点一测快乐周计划系列答案如下图是工业电解饱和食盐水的装置示意图,下列有关说法中不正确的是( )
| A.装置中出口①处的物质是氯气,出口②处的物质是氢气 |
| B.该离子交换膜只能让阳离子通过,不能让阴离子通过 |
C.装置中发生反应的离子方程式为:2Cl-+2H+ Cl2↑+H2↑ Cl2↑+H2↑ |
| D.该装置是将电能转化为化学能 |
原电池的电极名称不仅与电极的性质有关,也与电解质溶液有关,下列说法中不正确的是
| A.有Al、Cu、稀H2SO4组成原电池,其负极反应式为:Al-3 e-=Al3+ |
| B.Mg、Al、NaOH溶液组成原电池,其负极反应式为:Al-3 e-=Al3+ |
| C.由Fe、Cu、FeCl3溶液组成原电池,其负极反应式为:Fe-2e-═Fe2+, |
| D.由Al、Cu、浓硝酸组成原电池,其负极反应式为:Cu-2e-=Cu2+ |
 Fe2++H2↑。
Fe2++H2↑。


 ②
② ③
③ ④
④ ⑤
⑤ ⑥
⑥