��Ŀ����
��ҵ������ʱ�����ô�������Ӧ��SO2ת��ΪSO3��һ���Ĺؼ����衣
��1��ij�¶��£�SO2��g����![]() O2��g��
O2��g��![]() SO3��g����H����98 kJ��mol-1����ʼʱ��
SO3��g����H����98 kJ��mol-1����ʼʱ��
100 L���ܱ������м���4��0 mol SO2��g����10��0 mol O2��g��������Ӧ�ﵽƽ��ʱ���ų�����196 kJ�����¶���ƽ�ⳣ��K�� ��
(2)һ�������£���һ���������ܱ������г���2molSO2��1molO2���������з�Ӧ��
2SO2��g����O2��g��![]() 2SO3��g�����ﵽƽ���ı�����������SO2��O2��SO3����ƽ��Ũ�ȶ���ԭ��������� ������ĸ����
2SO3��g�����ﵽƽ���ı�����������SO2��O2��SO3����ƽ��Ũ�ȶ���ԭ��������� ������ĸ����
A�������¶Ⱥ�����������䣬����2 mol SO3
B�������¶Ⱥ�����������䣬����2 mol N2
C�������¶Ⱥ�����������䣬����0��5 mol SO2��0��25 mol O2
D�������¶Ⱥ�������ѹǿ���䣬����1 mol SO3
E�������¶�
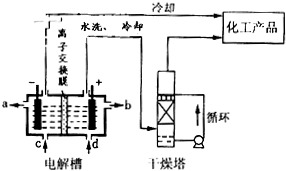
 ��3��ij����������ͼ��ʾװ���õ绯ѧԭ���������ᣬд��ͨ��SO2 �ĵ缫�ĵ缫��Ӧʽ�� ���������в�����SO42-�ľ������Ϊ ��
��3��ij����������ͼ��ʾװ���õ绯ѧԭ���������ᣬд��ͨ��SO2 �ĵ缫�ĵ缫��Ӧʽ�� ���������в�����SO42-�ľ������Ϊ ��
��4������ʱ��BaSO4��Ksp==1.08x10-10.�ֽ��������BaCl2��Һ��2.0x10-3mol/l��Na2SO4��Һ��ϡ���Ҫ����BaSO4������BaCl2��Һ����СŨ��Ϊ______________��
��5�����й���2SO2��g����O2��g��![]() 2SO3��g����Ӧ��ͼ���У���ȷ���� ��
2SO3��g����Ӧ��ͼ���У���ȷ���� ��

��6��SO2�����������л�ԭ�ԣ�����Ư���ԡ���SO2����ͨ������KMnO4�У�����KMnO4��ɫ������SO2���ֳ��������� ��
��1��10/3 ��2��A��C
��3��SO2��2e- ��2H2O �� SO42-�� 4H+�� ȡ������Һ���Թ��м������ᣬ�����������ټ���BaCl2��Һ����������ɫ����˵����Һ�к�SO42-��
(4)2.16x10-7mol/L ��5��ABD ��6����ԭ��