题目内容
11.短周期元素W、X、Y、Z的原子序数依次增大,其中W的阴离子的核外电子数与X、Y、Z原子的核外内层电子数相同.X的一种核素在考古时常用来鉴定一些文物的年代,工业上采用液态空气分馏方法来生产Y的单质,而Z不能形成双原子分子.根据以上叙述,下列说中正确的是( )| A. | W、X、Y、Z原子的核外最外层电子数的总和为22 | |
| B. | 上述四种元素的原子半径大小为W<X<Y<Z | |
| C. | 有W与X组成的化合物的沸点总低于由W与Y组成的化合物的沸点 | |
| D. | W与Y可形成既含极性共价键又含非极性共价键的化合物 |
分析 X的一种核素在考古时常用来鉴定一些文物的年代,用的是C14,采用的是断代法,则X为C元素;工业上采用液态空气分馏方法来生产Y的单质,这是工业上生产氮的方法,则Y为N元素;Z的原子序数大于X、Y,且不能形成双原子,所以可能是稀有气体Ne;X、Y、Z核外内层电子数相同,都应该是2个,则W为H元素,结合元素周期律的递变规律解答该题.
解答 解:X的一种核素在考古时常用来鉴定一些文物的年代,用的是C14,采用的是断代法,则X为C元素;工业上采用液态空气分馏方法来生产Y的单质,这是工业上生产氮的方法,则Y为N元素;Z的原子序数大于X、Y,且不能形成双原子,所以可能是稀有气体Ne;X、Y、Z核外内层电子数相同,都应该是2个,则W为H元素,
A.W、X、Y、Z原子的核外最外层电子数的总和为:1+4+5+8=18,故A错误;
B.W是H,X为C,Y为N,同周期元素从左到右元素的原子半径逐渐减小,则原子半径C>N,即:Y<X,故B错误;
C.W为H元素,X为C元素,Y为N元素,C和H可形成多种烃类化合物,当相对分子质量较大时,形成的烃在常温下为液体或固体,沸点较高,故C错误;
D.W与Y可形成N2H4的化合物,既含极性共价键又含非极性共价键,故D正确;
故选D.
点评 本题考查原子结构与元素周期律的关系,题目难度中等,正确推断元素的种类为解答该题的关键,易错点为C,注意碳氢化合物的种类以及性质,试题培养了学生的灵活应用基础知识的能力.

练习册系列答案
相关题目
10.某溶液既能溶解Al(OH)3,又能溶解Al,但不能溶解Fe,在该溶液中可以大量共存的离子组是( )
| A. | K+、Na+、HCO3-、NO3- | B. | Na+、SO42-、Cl-、S2- | ||
| C. | NH4+、Mg2+、SO42-、NO3- | D. | H+、K+、Cl-、Na+ |
2.在一定条件下,在一容积可变的密闭容器中,将SO2和O2混合发生反应:2SO2(g)+O2(g)?2SO3(g)△H=-92.3KJ/mol
0~4min时,容器气体压强为101KPa.反应过程中,SO2、O2、SO3的物质的量(mol)的变化如表:
回答下列问题:
①3~4min和7~9min时,反应处于平衡状态.
②第5min时,从速率和转化率两个方面分析,改变的外界条件是增大压强.
0~4min时,容器气体压强为101KPa.反应过程中,SO2、O2、SO3的物质的量(mol)的变化如表:
| 时间min | 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| n(SO2) | 2.00 | 1.92 | 1.84 | 1.76 | 1.76 | 1.64 | 1.52 | 1.40 | 1.40 | 1.40 |
| n(O2) | 1.00 | 0.96 | 0.92 | 0.88 | 0.88 | 0.82 | 0.76 | 0.70 | 0.70 | 0.70 |
| n(SO3) | 0 | 0.08 | 0.16 | 0.24 | 0.24 | 0.36 | 0.48 | 0.60 | 0.60 | 0.60 |
①3~4min和7~9min时,反应处于平衡状态.
②第5min时,从速率和转化率两个方面分析,改变的外界条件是增大压强.
6.化学与生产、生活、环境、社会密切相关,下列有关说法不正确的是( )
| A. | 航天服主要成分是由碳化硅、陶瓷和碳纤维复合而成的,它属于新型无机非金属材料 | |
| B. | 工业生产玻璃、水泥、陶瓷,均需要用到石灰石为原料 | |
| C. | 用二氧化碳合成聚碳酸酯可降解塑料,可以实现“碳”的循环利用 | |
| D. | 固体煤经过处理变为气体燃料后,可以减少SO2和烟尘的排放,且燃烧效率提高,有利于“节能减排” |
16.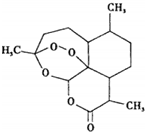 2015年诺贝尔生理学或医学奖授予中国药学家屠呦呦以及爱尔兰科学家威廉•坎贝尔和日本科学家大村智,表彰他们在寄生虫疾病治疗研究方面取得的成就.屠呦呦先驱性地发现了青蒿素,开创了疟疾治疗新方法.图为青蒿素,关于该物质的下列说法正确的是( )
2015年诺贝尔生理学或医学奖授予中国药学家屠呦呦以及爱尔兰科学家威廉•坎贝尔和日本科学家大村智,表彰他们在寄生虫疾病治疗研究方面取得的成就.屠呦呦先驱性地发现了青蒿素,开创了疟疾治疗新方法.图为青蒿素,关于该物质的下列说法正确的是( )
 2015年诺贝尔生理学或医学奖授予中国药学家屠呦呦以及爱尔兰科学家威廉•坎贝尔和日本科学家大村智,表彰他们在寄生虫疾病治疗研究方面取得的成就.屠呦呦先驱性地发现了青蒿素,开创了疟疾治疗新方法.图为青蒿素,关于该物质的下列说法正确的是( )
2015年诺贝尔生理学或医学奖授予中国药学家屠呦呦以及爱尔兰科学家威廉•坎贝尔和日本科学家大村智,表彰他们在寄生虫疾病治疗研究方面取得的成就.屠呦呦先驱性地发现了青蒿素,开创了疟疾治疗新方法.图为青蒿素,关于该物质的下列说法正确的是( )| A. | 青蒿素化学式为C15H20O5 | B. | 在光照条件下可能发生取代反应 | ||
| C. | 可以与氢气发生加成反应 | D. | 水浸青蒿对治疗疟疾有良好的疗效 |
3.下列关于有机化合物的结构、性质的叙述正确的是( )
| A. | 糖类、油脂、蛋白质的水解产物都是非电解质 | |
| B. | 甲烷和Cl2的反应与乙烯和Br2的反应属于同一类型的反应 | |
| C. | 蔗糖、麦芽糖的分子式均为C12H22O11,二者互为同分异构体 | |
| D. | 乙醇、乙酸均能与NaOH反应,因为分子中均含有官能团“-OH” |
20.常温下pH=1的醋酸溶液和pH=13的NaOH溶液,下列叙述中正确的是( )
| A. | 混合前醋酸溶液中水的电离程度大 | |
| B. | 混合前c(CH3COOH)大于c(Na+) | |
| C. | 混合后若c(Na+)=c(CH3COO-),则混合前乙酸体积大 | |
| D. | 分别稀释10倍,两溶液的pH之和大于14 |
1.在2L的密闭容器中,把4molA和2molB混合,在一定条件下发生反应:3A(g)+2B(g)?xC(g)+2D(g),2min后达到平衡时生成1.6molC,又测得反应速率v(D)=0.2mol/(L•min).下列说法正确的是( )
| A. | 消耗B 0.08mol | B. | x=2 | ||
| C. | A的平衡浓度是1.4mol/L | D. | 平衡时气体压强是原来的0.94倍 |
 +HO-NO2$→_{△}^{浓硫酸}$
+HO-NO2$→_{△}^{浓硫酸}$  +H2O;
+H2O; ;
; ,(写出其中的一种的结构简式).
,(写出其中的一种的结构简式).
 .
.