题目内容
 在100℃时,将0.40mol的二氧化氮气体充入2L真空的密闭容器中,每隔一段时间就对该容器内的物质进行分析,得到数据如表所示:
在100℃时,将0.40mol的二氧化氮气体充入2L真空的密闭容器中,每隔一段时间就对该容器内的物质进行分析,得到数据如表所示:| 时间(s) | 0 | 20 | 40 | 60 | 80 |
| n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
(2)n3
(3)若在相同情况下,最初向该容器中充入的是四氧化二氮气体,要达到上述同样的平衡状态,四氧化二氮的起始浓度是
(4)达到平衡后,如升高温度,气体颜色会变深,则升高温度后,反应2NO2(g)??Ν2O4(g)的平衡常数将
(5)达到平衡后,如向该密闭容器中再充入0.32mol氦气,并把容器体积扩大为4L,则平衡将
分析:(1)根据反应速率表达式v=
计算出从反应开始直至20s时,二氧化氮的平均反应速率;
(2)根据表中的数据可以判断60s时已经达到了平衡状态,据此进行判断n3和n4的大小;根据平衡常数的表达式及各组分的浓度计算出该反应的平衡常数;
(3)根据等效平衡,按照计算出将二氧化氮完全转化成四氧化二氮即可;根据二氧化氮和四氧化二氮及达到平衡时的浓度画出反应中N2O4和NO2的浓度随时间变化的曲线;
(4)根据升高温度,气体颜色会变深分析平衡移动方向及平衡常数的变化;
(5)根据稀有气体不影响各组分的浓度,容器容积增大,反应体系的仪器减小判断.
| △c |
| △t |
(2)根据表中的数据可以判断60s时已经达到了平衡状态,据此进行判断n3和n4的大小;根据平衡常数的表达式及各组分的浓度计算出该反应的平衡常数;
(3)根据等效平衡,按照计算出将二氧化氮完全转化成四氧化二氮即可;根据二氧化氮和四氧化二氮及达到平衡时的浓度画出反应中N2O4和NO2的浓度随时间变化的曲线;
(4)根据升高温度,气体颜色会变深分析平衡移动方向及平衡常数的变化;
(5)根据稀有气体不影响各组分的浓度,容器容积增大,反应体系的仪器减小判断.
解答:解:(1)从反应开始直至20s时,生成的四氧化二氮的物质的量为0.05mol,根据反应:2NO2?N2O4,消耗的二氧化氮物质的量为:0.1mol,二氧化氮的反应速率为:v(NO2)
=0.0025mol?L-1?s-1,
故答案为:0.0025;
(2)根据表中的数据可知,60s时反应达到了平衡状态,60s和80s时二氧化氮的物质的量相等,即n3=n4,
达到平衡状态时,n(N2O4)=0.08mol,n(NO2)=0.4mol-0.08mol×2=0.24mol,二者浓度分别为:c(N2O4)=
=0.04mol/L,c(NO2)=
=0.12mol/L,该该反应在该温度下的平衡常数为:
≈2.8,
故答案为:=;2.8;
(3)若在相同情况下,最初向该容器中充入的是四氧化二氮气体,要达到上述同样的平衡状态,说明两个反应为等效平衡,根据反应方程式,需要四氧化二氮的物质的量为:0.40mol×
=0.20mol,c(N2O4)=
=0.10mol/L,
反应开始时,c(N2O4)=0.10mol/L,c(NO2)=0,之后二氧化氮浓度逐渐增加,四氧化二氮浓度逐渐减小,
达到平衡时,根据(2)可知,c(N2O4)=0.04mol/L,c(NO2)=0.12mol/L,据此画出反应中N2O4和NO2的浓度随时间变化的曲线为: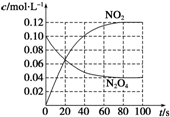
故答案为:0.10; ;
;
(4)由于升高温度,气体颜色会变深,说明化学平衡向着逆向移动,二氧化氮浓度增大,四氧化二氮浓度减小,所以平衡常数减小,
故答案为:减小;
(5)达到平衡后,如向该密闭容器中再充入0.32mol氦气,稀有气体不影响各组分的浓度,由于把容器体积扩大为4L,反应体系的压强减小,平衡向着体积增大的方向移动,即向左移动,
故答案为:向左移动.
| ||
| 20s |
故答案为:0.0025;
(2)根据表中的数据可知,60s时反应达到了平衡状态,60s和80s时二氧化氮的物质的量相等,即n3=n4,
达到平衡状态时,n(N2O4)=0.08mol,n(NO2)=0.4mol-0.08mol×2=0.24mol,二者浓度分别为:c(N2O4)=
| 0.08mol |
| 2L |
| 0.24mol |
| 2L |
| 0.04 |
| 0.122 |
故答案为:=;2.8;
(3)若在相同情况下,最初向该容器中充入的是四氧化二氮气体,要达到上述同样的平衡状态,说明两个反应为等效平衡,根据反应方程式,需要四氧化二氮的物质的量为:0.40mol×
| 1 |
| 2 |
| 0.20mol |
| 2L |
反应开始时,c(N2O4)=0.10mol/L,c(NO2)=0,之后二氧化氮浓度逐渐增加,四氧化二氮浓度逐渐减小,
达到平衡时,根据(2)可知,c(N2O4)=0.04mol/L,c(NO2)=0.12mol/L,据此画出反应中N2O4和NO2的浓度随时间变化的曲线为:

故答案为:0.10;
 ;
;(4)由于升高温度,气体颜色会变深,说明化学平衡向着逆向移动,二氧化氮浓度增大,四氧化二氮浓度减小,所以平衡常数减小,
故答案为:减小;
(5)达到平衡后,如向该密闭容器中再充入0.32mol氦气,稀有气体不影响各组分的浓度,由于把容器体积扩大为4L,反应体系的压强减小,平衡向着体积增大的方向移动,即向左移动,
故答案为:向左移动.
点评:本题考查了化学反应速率与化学计量数的关系、化学平衡的影响因素、化学平衡常数的计算等知识,题目难度中等,涉及的知识点较多,充分考查了学生对所学知识的掌握情况及灵活应用能力.

练习册系列答案
 小题狂做系列答案
小题狂做系列答案
相关题目
在100℃时,将0.40molNO2气体充入2L密闭容器中,每隔一段时间对该容器的物质进行测量,得到的数据如下表:
|
 氮可形成多种氧化物,如NO、NO2、N2O4等,NO2和N2O4可以相互转化.
氮可形成多种氧化物,如NO、NO2、N2O4等,NO2和N2O4可以相互转化.(1)对反应2NO2(g)?N2O4(g)△H=-57.2kJ?mol-1
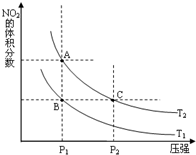
①在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示.T1
②A、C两点气体的平均相对分子质量:A
(2)在100℃时,将0.40mol的NO2气体充入2L的密闭容器中,每隔一定时间就对该容器内的物质进行分析,得到如表数据:
| 时间(s) | 0 | 20 | 40 | 60 | 80 |
| n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
②该条件下平衡常数K的值为
③若其他条件不变,下列既能加快正反应速率又能提高NO2转化率的措施是
④若在相同情况下最初向该容器充入的是N2O4气体,要达到上述同样的平衡状态,N2O4的起始的物质的量是
⑤若其它条件不变,只将容器改为带活塞的恒压容器,则平衡时N2O4的量
 在100℃时,将0.40mol二氧化氮气体充入2L抽空的密闭容器中,每隔一定时间就对该容器内的物质进行分析,得到如下表数据:
在100℃时,将0.40mol二氧化氮气体充入2L抽空的密闭容器中,每隔一定时间就对该容器内的物质进行分析,得到如下表数据:
 非金属元素氮有多种氧化物,如NO、NO2、N2O4等.
非金属元素氮有多种氧化物,如NO、NO2、N2O4等.