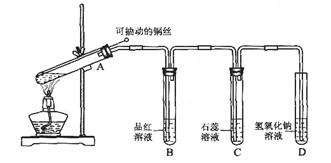
题目内容
实验是化学研究的基础。下列关于各实验装置的叙述不正确的是
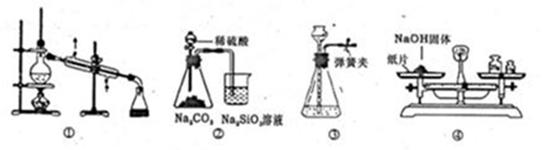

| A.装置①可用于乙醇与水的分离 |
| B.装置②所示实验可比较硫、碳、硅三种元素的非金属性强弱 |
| C.装置③,关闭弹簧夹,向长颈漏斗中注水后,长颈漏斗内水面高度保持不变能说明装置不漏气 |
| D.图④装置可用来称量一定质量的NaOH固体 |
D
试题分析:A、乙醇与水互溶,但二者的沸点相差较大,可以用蒸馏的方法分离,A正确;B、稀硫酸与碳酸钠反应生成CO2,CO2通入到硅酸钠溶液中,生成白色沉淀硅酸,所以装置②所示实验可比较硫、碳、硅三种元素的非金属性强弱,B正确;C、装置③,关闭弹簧夹,向长颈漏斗中注水后,长颈漏斗内水面高度保持不变,能说明装置不漏气,C正确;D、氢氧化钠具有吸水性和腐蚀性,用托盘天平称量时,应该非在烧杯中称量,D不正确,答案选D。

练习册系列答案
相关题目




 [Fe2(OH)n(SO4) 3-n/2 ] m,则水解反应的化学方程式为 。
[Fe2(OH)n(SO4) 3-n/2 ] m,则水解反应的化学方程式为 。