题目内容
20.NaCl是海水中提取出来的一种重要物质,除食用外,它还是一种工业原料,下列以NaCl为原料的产品是( )①烧碱 ②纯碱 ③金属钠 ④氯气 ⑤盐酸.
| A. | ①②③④⑤ | B. | 仅①②③④ | C. | 仅①③④⑤ | D. | 仅①③④ |
分析 电解饱和的食盐水即可得到氢气、氯气和氢氧化钠.利用氢氧化钠即可以生成碳酸钠,另外电解熔融的氯化钠则生成钠和氯气.
解答 解:①电解饱和的食盐水生成氢氧化钠和氢气、氯气,化学方程式:2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+Cl2↑+H2↑,可制得氢氧化钠,故①正确;
②电解饱和的食盐水可制得氢氧化钠,利用氢氧化钠即可以生成碳酸钠,如二氧化碳与氢氧化钠反应生成碳酸钠和水,化学方程式为:2NaOH+CO2=Na2CO3+H2O,故②正确;
③电解熔融的氯化钠,化学方程式:2NaCl$\frac{\underline{\;电解\;}}{\;}$2Na+Cl2↑,则生成钠,故③正确;
④电解熔融的氯化钠则生成氯气,电解饱和的食盐水生成氢氧化钠和氢气、氯气,故④正确;
⑤电解饱和的食盐水生成氢氧化钠和氢气、氯气,氢气与氯气反应生成氯化氢,氯化氢溶于水可得盐酸,故⑤正确;
故选A.
点评 本题考查氯化钠的性质和用途,题目难度不大,解题的关键是记住氯化钠的常见用途,特别须注意电解饱和的食盐水的反应原理.

练习册系列答案
相关题目
10.下列表示物质结构的化学用语或模型正确的是( )
| A. | 乙烯的结构简式:CH2CH2 | B. | CH4分子的比例模型: | ||
| C. | 羟基的电子式: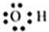 | D. | CCl4的电子式: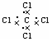 |
11.在标准状况下,进行甲、乙、丙三组实验:三组各取60mL 同浓度盐酸溶液,加入同一种镁铝合金粉末,产生气体,有关数据列表如下:则下列说法正确的是( )
| 实验序号 | 甲 | 乙 | 丙 |
| 合金质量/mg | 510 | 770 | 918 |
| 气体体积/mL | 560 | 672 | 672 |
| A. | 甲组和乙组的实验中,盐酸均是过量的 | |
| B. | 盐酸的物质的量浓度为0.8 mol/L | |
| C. | 合金中镁铝的物质的量之比为1:1 | |
| D. | 丙组充分反应后铝的物质的量为0.01mol |
8.下列叙述正确的是( )
| A. | 在水玻璃中通入过量二氧化碳,加热蒸干,最终得到混合物 | |
| B. | 铁件镀铜的目的是利用电化学防腐原理保护铁件不受腐蚀 | |
| C. | 制糖工业用活性炭脱色和制纸工业用次氯酸盐漂白纸浆的原理相同 | |
| D. | 使红色石蕊试纸变蓝的溶液中能大显存在Na+、Fe3+、NO3-、Cl- |
5.下列各组物质中,X是主体物质,Y是少量杂质,Z是为除去杂质所要加入的试剂,其中所加试剂正确的一组是( )
| A | B | C | D | |
| X | FeCl2溶液 | FeCl3溶液 | Fe | Na2SO4溶液 |
| Y | FeCl3 | CuCl2 | Al | Na2CO3 |
| Z | Cl2 | Fe | NaOH溶液 | HCl溶液 |
| A. | A | B. | B | C. | C | D. | D |
12.下列物质之需克服范德华力,就可气化的是( )
| A. | 液态氮 | B. | 液态氟化氢 | C. | 液态氨 | D. | 干冰 |
10.进行下列反应后,所得溶液中一定只含有一种溶质的是( )
| A. | 将铁粉加到稀硝酸中 | |
| B. | 向稀盐酸中滴入Na2CO3溶液 | |
| C. | 向MgSO4、H2SO4的混合溶液中加入过量的Ba(OH)2溶液 | |
| D. | 将CO2通入一定量的NaOH溶液中 |
 X、Y、Z、W四种短周期元素在周期表中的位置关系如图:
X、Y、Z、W四种短周期元素在周期表中的位置关系如图: .
.