题目内容
【题目】⑴合理膳食、均衡营养是保证人体健康和生活质量的重要途径。
① 人体必需的元素摄入不足会影响人体的正常生理活动。下列做法不能达到目的的是 。
a.补碘——食用加碘盐
b.补铁——使用铁强化酱油
c.补钙——服用葡萄糖
② 人体内有8种氨基酸必需通过食物摄入,某品牌饼干含有的下列物质中能转化为氨基酸的是 。
a.纤维素 b.蛋白质 c.油脂
③ 人类历史上最重要的抗生素是 。
a. 青霉素 b.维生素 c.胡萝卜素
⑵ 构建人与自然的和谐、营造安全的生态环境已成为全人类的共识。
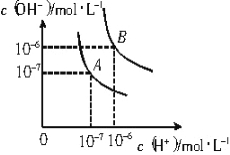
① 如图Ⅰ,向两只250mL的锥形瓶中分别充入CO2和空气,用白炽灯泡照射一段时间后,其中a瓶中温度计读数稍低,则盛放CO2的锥形瓶为 (填“a”或“b”)。

图Ⅰ 图Ⅱ
② 为防止白色污染,废旧的塑料需投入到贴有图II标志的垃圾桶内,该标志表示的是 。
③ 废水中铊(Tl)具有高毒性,治理时常加入NaClO溶液,将Tl+转变为Tl3+,NaClO作
(填“氧化剂”或“还原剂”),同时加入适量氨水,将Tl3+转变为难溶物Tl(OH)3,写出生成Tl(OH)3的离子方程式 。
⑶ 材料是人类社会发展的物质基础,材料科学的发展离不开化学。
① 黏土是陶瓷的生产原料,其中江苏宜兴的高岭土是含有杂质较少的高品质黏土,其主要组成可表示为Al2Si2Ox(OH)4,则x= 。
② 2016年奥运会在巴西举行,场馆的建设需大量的建筑材料。其中生产水泥、玻璃共同的原料是 (填名称),场馆内的座椅通常用高密度聚乙烯(HDPE)为原料制得,聚乙烯属于 塑料(填“热固性”或“热塑性”)。
③ 沪通铁路建设正在积极推进,其中如何防止铁轨的腐蚀是工程技术人员攻克的难题之一。铁在发生电化学腐蚀时的负极反应方程式为 。
④ 工业上常用SiCl4与O2在高温条件下通过置换反应制得SiO2,并于2000℃下拉成光纤细丝。该反应的化学方程式为 。
【答案】
⑴①c ;② b;③ a;
⑵①b ② 可回收垃圾 ③氧化剂;
Tl3++3NH3·H2O = Tl(OH)3↓+3NH4+ ;
⑶① 5 ;②石灰石(写碳酸钙不扣分) 热塑性;
③ Fe-2e= Fe2+ ;④SiCl4+O2![]() SiO2+2Cl2 ;
SiO2+2Cl2 ;
【解析】
试题分析:(1)①葡萄糖不含有钙元素,无法补钙,故答案为:c;
②蛋白质水解生成氨基酸,纤维素、油脂不含氮元素,故答案为:b;
③青霉素是抗生素,胡萝卜素生在人体内合成维生素A,故答案为:a;
(2)①二氧化碳就像温室的玻璃或塑料薄膜那样,具有保温的作用,温度高的为二氧化碳,故答案为:b;
②废旧的塑料可以回收利用,为可回收垃圾,故答案为:可回收垃圾;
③在废水中加入NaClO溶液,将Ti+转变为Ti3+,则NaClO中氯由+1价降低为-1价,为氧化剂,生成Tl(OH)3的离子方程式:Tl3++3NH3H2O=Tl(OH)3↓+3NH4+,故答案为:Tl3++3NH3H2O=Tl(OH)3↓+3NH4+;
(3)①铝、硅、氧、氢氧根分别显+3价、+4价、-2价、-1价,依据化合物中各元素的化合价代数和为0,则有(+3)×2+(+4)×2+(-2)×x+(-1)×4=0,即x=5,故答案为:5;
②生产玻璃的原料是纯碱、石灰石和石英,高温下,碳酸钠、碳酸钙和二氧化硅反应分别生成硅酸钠、硅酸钙;生产水泥以黏土和石灰石为主要原料,经研磨、混合后在水泥回转窑中煅烧,再加入适量石膏,并研成细粉就得到普通水泥.所以在玻璃工业、水泥工业中都用到的原料是石灰石即碳酸钙;聚乙烯为线型结构,故为热塑性塑料,故答案为:碳酸钙;热塑性;
③金属的电化学腐蚀分为吸氧腐蚀和析氢腐蚀,以吸氧腐蚀更为普遍,在两种电化学腐蚀中,负极都是金属铁发生失电子的氧化反应,即Fe-2e-=Fe2+,故答案为:Fe-2e-=Fe2+;
④SiCl4与O2在高温条件下通过置换反应制得SiO2,由于置换反应的概念是一种单质和一种化合物反应生成另一种单质和另一种化合物,故SiCl4与O2在高温条件下除了生成SiO2还生成氯气,故化学方程式为:SiCl4+O2![]() SiO2+2Cl2,故答案为:SiCl4+O2
SiO2+2Cl2,故答案为:SiCl4+O2![]() SiO2+2Cl2。
SiO2+2Cl2。

【题目】通过对煤的综合利用可得到洁净的燃料和多种化工原料,也可减少环境呢污染。煤的间接液化可得到甲醇。
(1)已知:CH3OH、H2的燃烧热(△H)分别为-726.5kJ/mol、-285.8kJ/mol,则常温下CO2和H2反应生成CH3OH和H2O的热化学方程式是____________。
(2)一定条件下,CO和H2合成CH3OH:CO(g)+2H2(g)![]() CH3OH(g)。
CH3OH(g)。
①在体积一定的密闭容器中按物质的量之比1:2充入CO和H2,测得平衡混合物中CH3OH的体积分数在不同压强下随温度的变化如图所示。
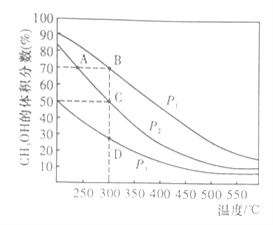
A、B、C三点平衡常数KA、KB、KC的大小关系是___________;压强:P1____P2(填“>”、“<”或“=”)
逆反应速率:v逆(A)______v逆(B)(填“>”、“<”或“=”)
在C点,CO的转化率为__________;
在C点,若再按物质的量之比1:2充入一定量的CO和H2,当其它条件不变,达到新的平衡时,CH3OH的体积分数__________(填“增大”、“减小”或“不变”)。
②若在恒温恒容条件下,能表示该可逆反应达到平衡状态的有__________。
A. 混合气体的密度保持不变
B. 混合气体的平均相对分子质量保持不变
C. 容器内的压强保持不变
D. 单位时间内每消耗1molCO的同时,生成2molH2
E. CO、H2、CH3OH的浓度保持不变
F. CO、H2、CH3OH的浓度之比为1:2:1
(3)氢硫酸、碳酸均为二元弱酸,其常温下的电离常数如下表:
H2CO3 | H2S | |
Ka1 | 4.4×10-7 | 1.3×10-7 |
Ka2 | 4.7×10-11 | 7.1×10-15 |
煤的气化过程中产生的有害气体H2S可用足量的Na2CO3溶液吸收,该反应的离子方程式为________;常温下,0.1mol·L-1NaHCO3溶液和0.1mol·L-1NaHS溶液的pH相比,pH较小的为______溶液(填化学式)。