题目内容
【题目】为研究用AgNO3溶液将混合溶液中的Cl-和CrO42-沉淀分离,绘制了25℃时AgCl和Ag2CrO4两种难溶化合物的溶解平衡曲线。其中,pAg+=-lgc(Ag+),其余离子类推。两条相交曲线把图像分成了X、Y、Z、M四个区域。下列说法错误的是( )
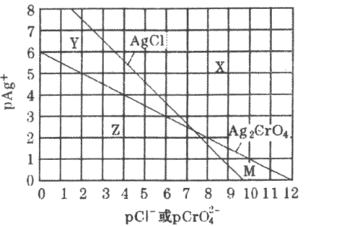
A.Ksp(Ag2CrO4)约为1×10-12,Ksp(AgCl)的数量级为10-10
B.M区域内可析出Ag2CrO4沉淀,而不析出AgCl沉淀
C.向Ag2CrO4,AgCl混合固体和水组成的溶解平衡体系中加入少量水,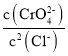 增大
增大
D.向Cl-,CrO42-均为0.1mol·L-1的混合溶液中逐滴加入稀硝酸银溶液,先析出AgCl沉淀
【答案】C
【解析】
A.当纵坐标为0,即c(Ag+)=1.0mol·L-1时,Ksp(Ag2CrO4)=c2(Ag+)·c(CrO42-)=(10-6)2=10-12,同理可得Ksp(AgCl)=c(Ag+)·c(Cl-)=10-9.9,数量级为10-10,A正确,不选;
B.曲线上的点为溶解平衡点,M区域相对于AgCl溶解平衡曲线,c(Ag+)和c(Cl-)均减小,不析出AgCl沉淀,相对于Ag2CrO4溶解平衡曲线,c(Ag+)和c(CrO42-)均增大,可析出Ag2CrO4沉淀,B正确,不选;
C.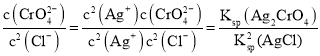 ,平衡体系中加入少量水,Ksp(Ag2CrO4)和Ksp(AgCl)均不变,
,平衡体系中加入少量水,Ksp(Ag2CrO4)和Ksp(AgCl)均不变, 也不变,C错误,符合题意;
也不变,C错误,符合题意;
D.从图上看,Cl-,CrO42-均为0.1mol·L-1,即横坐标均为1时,AgCl沉淀所需的pAg+较大,即c(Ag+)较小,先析出AgCl沉淀,D正确,不选;
答案选C。

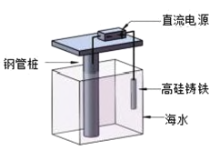
【题目】某海水中主要离子的含量如下表,现利用“电渗析法”进行淡化,技术原理如图所示(两端为惰性电极,阳膜只允许阳离子通过,阴膜只允许阴离子通过)。下列有关说法错误的是( )
离子 |
|
|
|
|
|
|
|
含量 | 9360 | 83 | 200 | 1100 | 16000 | 1200 | 118 |
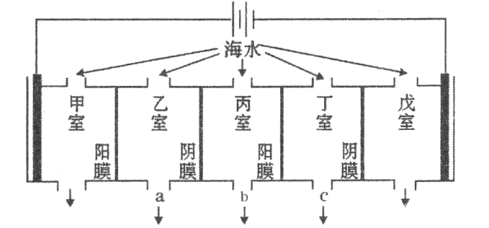
A.甲室的电极反应式为:![]()
B.乙室和丁室中部分离子的浓度增大,淡水的出口为b
C.当戊室收集到![]() (标准状况)气体时,通过甲室阳膜的离子的物质的量一定为
(标准状况)气体时,通过甲室阳膜的离子的物质的量一定为![]()
D.淡化过程中易在戊室形成水垢