题目内容
20.有人设计出利用CH4和O2的反应,用铂电极在KOH溶液中构成燃料电池.电池的总反应类似于CH4在O2中燃烧,则下列说法正确的是( )| A. | 每消耗1molCH4可以向外电路转移4mol电子 | |
| B. | 负极上CH4失去电子,电极反应式为CH4+10OH--8e-═CO32-+7H2O | |
| C. | 负极上是O2获得电子,电极反应式为:O2+2H2O+4e-═4OH- | |
| D. | 电池放电后,溶液pH不断升高 |
分析 碱性甲烷燃料电池,具有还原性的甲烷为原电池的负极,发生氧化反应,电极反应式为CH4+10OH--8e-=CO32-+7H2O,通入氧气的一极为原电池的正极,发生还原反应,电极反应式为O2+2H2O+4e-=4OH-,原电池工作时,电子从负极经外电路流向正极,电解质溶液中,阳离子向正极移动,阴离子向负极移动.
解答 解:A、通入CH4的电极为负极,电极反应为:CH4+10OH--8e-=CO32-+7H2O,每消耗1molCH4可以向外电路提供8mole-,故A错误;
B、通入CH4的电极为负极失电子反应氧化反应,电极反应为CH4+10OH--8e-=CO32-+7H2O,故B正确;
C、通入氧气的一极为原电池的正极,得到电子发生还原反应:O2+2H2O+4e-=4OH-,故C错误;
D、电池反应式为:CH4+2OH-+2O2=CO32-+3H2O,随着反应的进行,溶液中氢氧根离子不断减少,溶液pH不断减小,所以该电池使用一段时间后应补充KOH,故D错误;
故选B.
点评 本题考查碱性甲烷电池的工作原理,题目难度不大,本题中注意把握电极反应式的书写,正确判断两极的化学反应,在学习中注意积累电子、电流、离子的流向.

练习册系列答案
相关题目
10.某混合物X由Al2O3、Fe2O3、Cu、SiO2中的一种或几种物质组成.现进行如图所示实验.

下列有关说法正确的是( )

下列有关说法正确的是( )
| A. | 步骤Ⅰ中减少的3 g固体一定是混合物 | |
| B. | 步骤Ⅱ中质量减少的固体物质一定是Fe2O3 | |
| C. | 根据上述步骤Ⅱ可以得出蓝色溶液中n(Cu2+)=0.02 mol | |
| D. | 根据步骤Ⅰ、Ⅱ可以判断X中氧化铁的质量分数为50% |
11.原子序数依次增大的X、Y、Z、M、W为五种短周期元素.已知Y与Z、M与W分别同周期,X与M同主族;X、Z、M的质子数之和等于Y、W的质子数之和;X与Z、M与Z都可以分别形成A2B、A2B2型的化合物;X与Y形成的气态化合物在标准状况下的密度为0.76g•L-1;Y、M、W的最高价氧化物的水化物,两两间都能发生反应.下列说法正确的是( )
| A. | W的最高价氧化物和SiO2都是两性氧化物 | |
| B. | 只含X、Y、Z三种元素的某水溶液一定呈酸性 | |
| C. | 由X、M与Z形成的化合物X2Z2和M2Z2中所含的化学键类型相同 | |
| D. | M的单质可用于从钛、锆等金属的氯化物中制备钛、锆等单质 |
15.石墨烯的结构示意图如图所示,下列说法正确的是( )
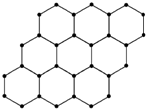

| A. | 石墨烯与石墨互称为同位素 | |
| B. | 12 g石墨烯中约含有6.02×1023个电子 | |
| C. | 石墨烯中可能含有离子键 | |
| D. | 石墨烯中的碳原子间以共价键相结合 |
5.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 1 L 1 mol•L-1的NaClO溶液中含有ClO-的数目为NA | |
| B. | 78 g苯含有C=C键的数目为3 NA | |
| C. | 分子数目为0.1NA的N2和NH3混合气体,原子间含有的共用电子对数目为0.3NA | |
| D. | 1 mol FeI2与足量氯气反应时转移的电子数为2 NA |
9.某混合物X由Al2O3、Fe2O3、Cu、SiO2中的一种或几种物质组成.现进行如图所示实验.下列有关说法正确的是( )
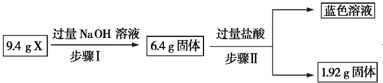

| A. | 根据上述步骤Ⅱ可以得出蓝色溶液中n(Cu2+)=0.02 mol | |
| B. | 步骤Ⅱ中质量减少的固体物质一定是Fe2O3 | |
| C. | 步骤Ⅰ中减少的3 g固体一定是混合物 | |
| D. | 根据步骤Ⅰ、Ⅱ可以判断X中氧化铁的质量分数为50% |
18.下列说法正确的是( )
| A. | 按系统命名法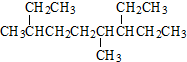 的名称为:4,7-二甲基-3-乙基辛烷 的名称为:4,7-二甲基-3-乙基辛烷 | |
| B. | 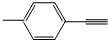 分子中所有原子共平面 分子中所有原子共平面 | |
| C. | 肌醇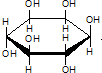 与葡萄糖的元素组成相同,化学式均为C6H12O6,满足Cm(H2O)n,因此,二者均属于糖类化合物 与葡萄糖的元素组成相同,化学式均为C6H12O6,满足Cm(H2O)n,因此,二者均属于糖类化合物 | |
| D. | 1.0 mol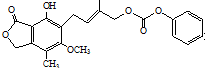 最多能与含5 mol NaOH的水溶液完全反应 最多能与含5 mol NaOH的水溶液完全反应 |
 )是一种重要的化工原料,在药物、新材料等方面有重要的应用,合成该有机物的一种路线如图:
)是一种重要的化工原料,在药物、新材料等方面有重要的应用,合成该有机物的一种路线如图: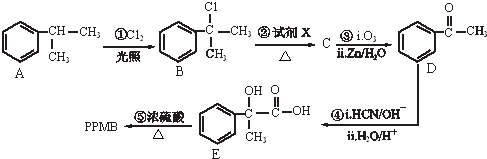
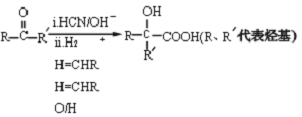
 .
. .
. 有X、Y、Z、W、P、Q六种前两周期的主族元素,原子序数依次增大,价电子数之和为26,原子半径依Y、Z、W、P、Q、X依次减小.围绕上述元素,回答下列问题:
有X、Y、Z、W、P、Q六种前两周期的主族元素,原子序数依次增大,价电子数之和为26,原子半径依Y、Z、W、P、Q、X依次减小.围绕上述元素,回答下列问题: ,YQ3中心原子的杂化类型为sp2,Z与Q两元素第一电离能的大小关系:Z<Q(填“>”、“<”或“=”).
,YQ3中心原子的杂化类型为sp2,Z与Q两元素第一电离能的大小关系:Z<Q(填“>”、“<”或“=”). ,其与水反应的化学方程式为NH4H+H2O=NH3•H2O+H2↑.
,其与水反应的化学方程式为NH4H+H2O=NH3•H2O+H2↑.