题目内容
Ⅰ请写出Na2SO3固体在空气中变质的化学方程式______________
Ⅱ实验室中欲检验Na2SO3固体样品是否已经变质,最简单的方法为______________
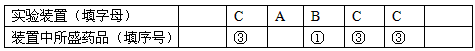
选用以下装置和药品通过测定生成SO2的质量,可计算Na2SO3固体样品的纯度。反应原理:
H2SO4(浓)+ Na2SO3= Na2SO4 + SO2↑+ H2O
供选用的药品:①浓硫酸 ②浓硝酸 ③碱石灰 ④空气 供选用的装置(同一装置可重复选用):


Ⅱ取适量样品溶解,加入足量的盐酸酸化的氯化钡溶液,充分反应后,若有白色沉淀存在,证明Na2SO3已经变质;若无白色沉淀,证明Na2SO3未变质。(或取适量样品溶解,先加入足量氯化钡溶液,产生白色沉淀,再加足量稀盐酸,若仍有白色沉淀存在,证明Na2SO3已经变质;若白色沉淀完全消失,证明
Na2SO3未变质。)
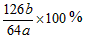

硬质玻璃管是化学实验中经常使用的一种仪器,请分析下列实验(固定装置略)并回答问题。
Ⅰ、硬质玻璃管常作为气体和固体反应的场所,如图(其他装置省略,必要时可加热)。

下列实验描述不正确的是
A、固体A为无水硫酸铜时,可以检验气体X中是否含有水蒸气
B、固体A为铜时,可以除去N2中的O2
C、在空气流作用下,加热氯化铁晶体得到纯净的无水氯化铁
D、将氨气和空气混合气通过灼热的铂丝,可看到有红棕色气体生成
Ⅱ、进行微量实验:如图所示,将浓硫酸滴入装有Na2SO3固体的培养皿一段时间后,
a、b、c三个棉球变化如下表。请填写表中的空白:

|
棉球 |
棉球上滴加的试剂 |
实验现象 |
解释和结论 |
|
a |
|
棉球变白,微热后又恢复红色 |
|
|
b |
含酚酞的NaOH溶液 |
棉球变为白色 |
离子方程式:
|
|
c |
|
棉球变为白色 |
结论:该气体具有 性 |
某同学想通过下图装置实验,探究SO2与Na2O2反应的产物。
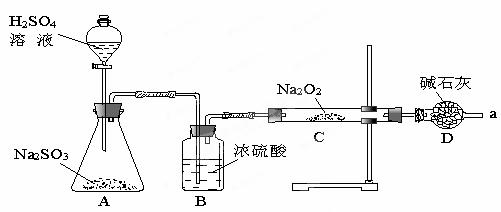
Ⅰ.检验反应中是否有O2生成的方法是 ;若有O2生成,请写出装置C中的化学方程式 。
Ⅱ .A中盛装H2SO4溶液的仪器名称是____________;D装置除起了防止空
气中的水蒸气和二氧化碳进入C装置与Na2O2反应作用外,还可以 。
Ⅲ.(1)C中固体产物可能只有Na2SO3、只有 、Na2SO3和Na2SO4两种都有。
(2)若Na2O2反应完全,为确定C中固体产物的成分,该同学设计如下,请您利用限选试剂和仪器帮助他完成该探究过程,并将答案写在答题卡相应位置。
限选试剂和仪器: 0.1mol/LKMnO4酸性溶液、0.01mol/LKMnO4酸性溶液、0.1mol/LBa(NO3)2溶液、0.1mol/LBaCl2溶液、1mol/L HNO3溶液、1mol/L盐酸、试管、胶头滴管。
| 实验操作 | 预期现象和结论 |
| 步骤一:取少量C中固体产物于试管中,加入适量的蒸馏水、搅拌溶解,分别取少量于A、B试管中。 | 固体完全溶解,得到无色透明溶液 |
| 步骤二:取试管A,向溶液中加入 ,振荡,观察溶液颜色变化。 | 若 ; 则 。 |
| 步骤三:取试管B,向其中先加入 ,振荡;再加入 ,振荡。 | 产生 , 再加入另一试剂看到产生白色沉淀,则 固体C中还含有 。 |

 为测定Na3CO3与Na2SO3混合物中各组分的含量,取样品23.2g,用下图所示装置进行实验(铁架台、铁夹等仪器未在图中画出):
为测定Na3CO3与Na2SO3混合物中各组分的含量,取样品23.2g,用下图所示装置进行实验(铁架台、铁夹等仪器未在图中画出): 证氯元素的非金属性比硫元素的
证氯元素的非金属性比硫元素的