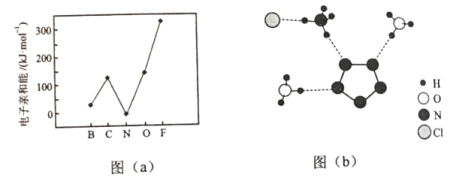
题目内容
【题目】钒和五氧化二钒在工业应用中广泛,某工厂从钒渣中回收金属,钒渣中主要成分有V2O3、FeO,还含有少量的CuO、Al2O3,工艺流程如图:
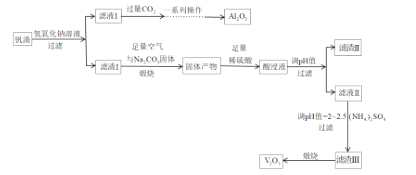
已知:①KspCu(OH)2=1.0×1021;KspFe(OH)3=4.0×1038;KspFe(OH)2=8.0×1016。
②NH4VO3难溶于水,(VO2)2SO4易溶于水。
(1)写出滤液I中加入过量的CO2时发生反应的离子方程式;制取纯净的Al2O3需要经过一系列操作:过滤、___、___。
(2)煅烧时,滤渣I的主要成分V2O3转化为可溶性NaVO3,写出其反应的化学方程式___。
(3)加入稀硫酸后,酸浸液中VO3与VO2+能大量共存的原因是___(用离子方程式解释)。
(4)常温下调节酸浸液的pH=___,即可以完全除去铁、铜两种元素对应的离子___;实际pH值要调整到8,其目的是___;调pH=2~2.5后过滤,滤渣III的主要成分为___。
(5)请写出煅烧滤渣III时,发生反应的化学方程式___。
【答案】AlO2-+CO2+2H2O=Al(OH)3↓+HCO3- 洗涤 灼烧(或煅烧) V2O3+Na2CO3+O2![]() 2NaVO3+CO2↑ VO2++H2O
2NaVO3+CO2↑ VO2++H2O![]() VO3-+2H+ 6 使VO2++H2O
VO3-+2H+ 6 使VO2++H2O![]() VO3-+2H+正向移动,VO2-更多地转化为VO3+ NH4VO3 2NH4VO3
VO3-+2H+正向移动,VO2-更多地转化为VO3+ NH4VO3 2NH4VO3![]() V2O5+2NH3↑+H2O
V2O5+2NH3↑+H2O
【解析】
(1)钒渣中主要成分有V2O3、FeO,还含有少量的CuO、Al2O3,当向钒渣中加入氢氧化钠溶液时,Al2O3与氢氧化钠溶液反应生成偏铝酸钠,其他物质与氢氧化钠溶液不反应,向滤液I中加入过量的CO2时,在溶液中偏铝酸钠与CO2反应生成Al(OH)3,Al(OH)3受热分解生成Al2O3;
(2)煅烧时,滤渣I的主要成分V2O3与空气中的氧气、碳酸钠在煅烧的条件下反应生成NaVO3,依据氧化还原反应中得失电子守恒配平方程式;
(3)加入稀硫酸后,VO3-+2H+![]() VO2++H2O;
VO2++H2O;
(4)结合KspCu(OH)2=1.0×1021,KspFe(OH)3=4.0×1038,常温下调节酸浸液的pH,除去铁、铜两种元素对应的离子,减少对V2O5的影响;
(5)结合题中的信息以及工艺流程图,NH4VO3煅烧生成V2O5。
(1)Al2O3与氢氧化钠溶液反应生成偏铝酸钠,其他物质与氢氧化钠溶液不反应,滤液I中偏铝酸钠与过量的CO2反应生成Al(OH)3和NaHCO3,反应的离子方程式为AlO2-+CO2+
2H2O=Al(OH)3↓+HCO3- ;滤液I中偏铝酸钠与过量的CO2反应生成Al(OH)3和NaHCO3,过滤得Al(OH)3,然后洗涤Al(OH)3,最后煅烧Al(OH)3生成Al2O3;
(2)煅烧时,滤渣I的主要成分V2O3与空气中的氧气、碳酸钠在煅烧的条件下反应生成NaVO3,反应的化学方程式为V2O3+Na2CO3+O2![]() 2NaVO3+CO2↑;
2NaVO3+CO2↑;
(3)加入稀硫酸后,酸浸液中VO3与VO2+能大量共存的原因是VO3-+2H+![]() VO2++H2O;
VO2++H2O;
(4)当c(Cu2+)=1.0×105molL1时,1.0×105×c2(OH-)=1.0×1021,c(OH-)=1.0×108 molL1,c(H+)=1.0×106molL1,pH=6,即pH=6时,Cu2+完全沉淀;当c(Fe3+)=1.0×105molL1时,1.0×105×c3(OH-)=4.0×1038,c (OH-)=![]() ×1011 molL1,c(H+)>1.0×106molL1,所以当pH=6时,Fe3+、Cu2+已经沉淀完全;实际pH值要调整到8,其目的是使VO2++H2O
×1011 molL1,c(H+)>1.0×106molL1,所以当pH=6时,Fe3+、Cu2+已经沉淀完全;实际pH值要调整到8,其目的是使VO2++H2O![]() VO3-+2H+正向移动,VO2-更多地转化为VO3+;因为NH4VO3难溶于水,(VO2)2SO4易溶于水,所以加入硫酸铵调pH=2~2.5后过滤,滤渣III的主要成分为NH4VO3;
VO3-+2H+正向移动,VO2-更多地转化为VO3+;因为NH4VO3难溶于水,(VO2)2SO4易溶于水,所以加入硫酸铵调pH=2~2.5后过滤,滤渣III的主要成分为NH4VO3;
(5)滤渣III的主要成分为NH4VO3,所以煅烧滤渣III时,发生反应的化学方程式为2NH4VO3![]() V2O5+2NH3↑+H2O 。
V2O5+2NH3↑+H2O 。

 名校课堂系列答案
名校课堂系列答案