��Ŀ����
����Ŀ��CoC2O4���Ʊ������ܵ�ԭ�ϡ����ú��ܷ��ϣ���Ҫ�ɷ�ΪCo2O3��������Fe2O3��Al2O3��CaO��MgO��̼���л���ȣ���ȡCoC2O4�Ĺ����������£�
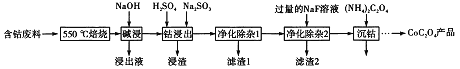
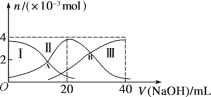
��1����500�����ա���Ŀ����_______��
��2��������Һ������Ҫ�ɷ���_______��
��3�����ܽ�����������Co3+ת��ΪCo2+����Ӧ�����ӷ���ʽΪ_________��
��4������������1�������У�����40��50�����H2O2��Һ����Ŀ����_____________���������ӷ���ʽ��ʾ������������80��85�棬����Na2CO3��Һ����pH��5��������I������Ҫ�ɷ���___________��
��5��Ϊ�ⶨ�Ƶõ�CoC2O4��Ʒ�Ĵ��ȣ��ֳ�ȡ1.00g��Ʒ���������ʵ��Լ�ת��Ϊ�����[(NH4��2C2O4����Һ�����ù���ϡ�����ữ����0.1000mol/L���������Һ�ζ����ﵽ�ζ��յ㣬����ȥ���������Һ26.00mL���ò�Ʒ�Ĵ���Ϊ_______________��
���𰸡���ȥ̼���л��� NaAlO2(NaAlO2��NaOH��Ca(OH)2Ҳ�ɵ÷�) 2Co3++SO32-+H2O=2Co2++SO42-+2H+ 2Fe2++2H++H2O2=2Fe3++2H2O Fe(OH)3����Fe(OH)3��CaSO4��CaCO3������һ�ֻ����ֶ����֣� 95.55%
��������
���ܷ�����Ҫ�ɷ�ΪCo2O3��������Fe2O3��Al2O3��CaO��MgO��̼���л������550�����տ��Գ�ȥ̼���л�������������������Һ,�����������ܽ�����ƫ�������� Co2O3��Fe2O3��MgO�����������������Һ����Ҫ�ɷ�Ϊƫ�����ƣ���NaAlO2��NaOH��Ca(OH)2��������˵õ��Ĺ����м���ϡ����������������������ƽ�Co3+��Fe3+��ԭΪCo2+��Fe2+���ɵ�Co2+��Fe2+��Mg2+��Ca2+����40��50�����H2O2������Fe2+����ΪFe3+����������80��85��,����̼���Ƶ�pH��5,�ɵõ�������������,���˺�������Һ��Ҫ����Co2+��Mg2+��Ca2+���ⶨCoC2O4��Ʒ�Ĵ��ȣ�����5 CoC2O4-5[(NH4��2C2O4��-2KMnO4��ϵ���������CoC2O4�����������������Ʒ�Ĵ��ȣ������Ϸ������
���ܷ�����Ҫ�ɷ�ΪCo2O3��������Fe2O3��Al2O3��CaO��MgO��̼���л������550�����տ��Գ�ȥ̼���л�������������������Һ,�����������ܽ�����ƫ�������� Co2O3��Fe2O3��MgO�����������������Һ����Ҫ�ɷ�Ϊƫ�����ƣ���NaAlO2��NaOH��Ca(OH)2��������˵õ��Ĺ����м���ϡ����������������������ƽ�Co3+��Fe3+��ԭΪCo2+��Fe2+���ɵ�Co2+��Fe2+��Mg2+��Ca2+����40��50�����H2O2������Fe2+����ΪFe3+����������80��85��,����̼���Ƶ�pH��5,�ɵõ�������������,���˺�������Һ��Ҫ����Co2+��Mg2+��Ca2+���ⶨCoC2O4��Ʒ�Ĵ��ȣ�����5 CoC2O4-5[(NH4��2C2O4��-2KMnO4��ϵ���������CoC2O4�����������������Ʒ�Ĵ��ȣ�
��1��������Ϸ�����֪����550�����ա����Գ�ȥ̼���л��������������������������ȥ̼���л��
��2��������Ϸ�����֪����������������Һ,�������ܽ�����ƫ�����������Խ���Һ����Ҫ�ɷ�Ϊƫ�����ƣ���NaAlO2��NaOH��Ca(OH)2��������������������ǣ�NaAlO2(NaAlO2��NaOH��Ca(OH)2Ҳ�ɵ÷�)��
��3�����ܽ�����������Co3+ת��ΪCo2+����SO32-��Co3+��ԭΪCo2+������������ΪSO42-����Ӧ���ӷ���ʽΪ��2Co3++SO32-+H2O=2Co2++SO42-+2H+������������������ǣ�2Co3++SO32-+H2O=2Co2++SO42-+2H+��
��4������������1�������У�����40��50�����H2O2��Һ��������������Ϊ�����ӣ�2Fe2++2H++H2O2=2Fe3++2H2O����������80��85�棬����Na2CO3��Һ����pH��5�����Եõ������������������ԡ�����I������Ҫ�ɷ���Fe(OH)3��Fe(OH)3��CaSO4��CaCO3������һ�ֻ����־��ɣ�������������������ǣ�2Fe2++2H++H2O2=2Fe3++2H2O�� Fe(OH)3����Fe(OH)3��CaSO4��CaCO3������һ�ֻ����ֶ����֣���
��5����ȡ1.00g��Ʒ���������ʵ��Լ�ת��Ϊ�����[(NH4��2C2O4����Һ�����ù���ϡ�����ữ����0.1000mol/L���������Һ�ζ����ﵽ�ζ��յ㣬����ȥ���������Һ26.00mL�����ݵ��ӵ�ʧ�غ���Եó�5 CoC2O4-5[(NH4��2C2O4��-2KMnO4��ϵ������m(CoC2O4)=5/2��26��10-3��0.1��147=0.955g����������Ʒ�Ĵ���Ϊ0.9555/1��100%=95.55%������������������ǣ�95.55%��

����Ŀ�����и��������У��������ͼʾ������ͨ����������һ��ת����ȫ������ǣ� ��
��� | X | Y | Z | W |
|
�� | Si | SiO2 | Na2SiO3 | H2SiO3 | |
�� | Na | NaOH | Na2CO3 | NaCl | |
�� | Cu | CuCl2 | Cu(OH)2 | CuSO4 | |
�� | Fe | FeCl3 | FeCl2 | Fe(OH)2 |
A. �٢�B. �٢ۢ�C. �ڢ�D. �٢�