题目内容
【题目】室温下,H2R及其钠盐的混合溶液中,H2R、HR-、R2-分别在三者中所占的物质的量分数(α)随溶液pH的变化关系如图所示。下列叙述错误的是
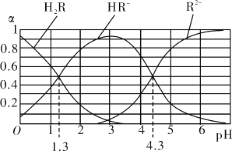
A. 由图可知:H2R的pKa1=1.3(已知:pKa= -lgKa)
B. 在pH=4.3的溶液中:3c(R2-) > c(Na+)
C. 0.2mol/L H2R溶液与0.3mol/L NaOH溶液等体积混合后的溶液中pH=4.3
D. 在pH=3的溶液中存在 ![]() =10-3
=10-3
【答案】C
【解析】
A.先计算Ka1,再计算pKa1;
B.结合溶液中电荷守恒进行分析;
C.结合溶液中离子种类进行分析;;
D.求出Ka1、Ka2,c(R2﹣)·c(H2R)/ c2(HR﹣)= Ka2·1/Ka1,据此分析;
A.Ka1=c(HR﹣)·c(H+)/c(H2R),当pH=1.3时c(HR﹣)=c(H2R),即Ka1=10-1.3,则pKa1=1.3,故A项正确;
B.在pH=4.3的溶液中,c(R2﹣)=c(HR﹣),溶液中电荷守恒为:2c(R2﹣)+c(HR﹣)+c(OH﹣)=c(Na+)+c(H+),所以3c(R2-)=c(Na+)+c(H+)﹣c(OH﹣),溶液呈酸性,即3c(R2-) > c(Na+),故B项正确;
C.0.2mol/L H2R溶液与0.3mol/L NaOH溶液等体积混合后,得到0.15mol/L Na2R和0.05mol/L NaHR混合溶液,此时c(R2﹣)>c(HR﹣),则pH>4.3,故C项错误;
D.根据pH=1.3时离子浓度求出Ka1=c(HR﹣)·c(H+)/c(H2R)=10-1.3,根据pH=4.3时离子浓度求出Ka2=c(R2﹣)·c(H+)/c(HR﹣)=10-4.3,Ka2·1/Ka1= c(R2﹣)·c(H2R)/ c2(HR﹣)=10-3,故D项正确;
综上,本题选C。

 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案 导学与测试系列答案
导学与测试系列答案【题目】将一定量的SO2(g)和O2(g)分别通入体积为2L的恒容密闭容器中,在不同温度下进行反应,得到如下表中的两组数据:已知2SO2(g)+ O2(g) ![]() 2SO3(g) △H<0
2SO3(g) △H<0
实验 编号 | 温度/℃ | 平衡常数 | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
SO2 | O2 | SO2 | O2 | ||||
1 | T1 | K1 | 4 | 2 | x | 0.8 | 6 |
2 | T2 | K2 | 4 | 2 | 0.4 | y | t |
下列说法中不正确的是
A. x=2.4
B. T1、T2的关系:T1>T2
C. K1、K2的关系:K2>K1
D. 实验1在前6 min的反应速率v(SO2)=0.2 mol·L-1·min-1