题目内容
【题目】常温下,下列各溶液中微粒的物质的量浓度关系正确的是
①c(NH![]() )相等的(NH4)2SO4、NH4HSO4、NH4Cl溶液中:c(NH4HSO4)>c[(NH4)2SO4]>c(NH4Cl)
)相等的(NH4)2SO4、NH4HSO4、NH4Cl溶液中:c(NH4HSO4)>c[(NH4)2SO4]>c(NH4Cl)
②向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液:c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
③1.0mol/LNa2CO3溶液:c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3)
④某二元弱酸的酸式盐NaHA溶液中:c(H+)+c(Na+)=c(OH-)+c(HA-)+c(A2-)
⑤将pH=6的H2SO4稀释1000倍后,c(H+)=200c(SO![]() )
)
A.①②B.③⑤C.④⑤D.②④
【答案】B
【解析】
①(NH4)2SO4溶液中铵根离子水解,NH4HSO4溶液中电离出的氢离子抑制铵根离子水解,NH4Cl溶液中铵根离子水解,c(NH4+)相等时,溶质浓度c(NH4Cl)>c(NH4HSO4)]>c((NH4)2SO4),故①错误;
②向醋酸钠溶液中加入适量醋酸,溶液中醋酸电离程度大于醋酸根离子水解程度,得到的酸性混合溶液存在电荷守恒:c(Na+)+c(H+)=c(CH3COO)+c(OH),得到的酸性混合溶液,c(H+)>c(OH),c(Na+)<c(CH3COO),c(CH3COO-)>c(Na+)>c(H+)>c(OH-),故②错误;
③1.0mol/LNa2CO3溶液中存在质子守恒:c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3),故③正确;
④某二元弱酸的酸式盐NaHA溶液中一定存在电荷守恒c(H+)+c(Na+)=c(OH-)+c(HA-)+2c(A2-),故④错误;
⑤将pH=6的H2SO4氢离子的浓度为c(H+)=10-6,c(SO![]() )=5×10-7,稀释1000倍后,c(H+)≈10-7,c(SO
)=5×10-7,稀释1000倍后,c(H+)≈10-7,c(SO![]() )=5×10-10,c(H+)=200c(SO
)=5×10-10,c(H+)=200c(SO![]() ),故⑤正确;
),故⑤正确;
正确的是③⑤,答案选B。

 优等生题库系列答案
优等生题库系列答案 53天天练系列答案
53天天练系列答案【题目】在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
物质 | X | Y | Z |
初始浓度/mol·L-1 | 0.1 | 0.2 | 0 |
平衡浓度/mol·L-1 | 0.05 | 0.05 | 0.1 |
下列说法错误的是:
A. 反应达到平衡时,X的转化率为50% B. 反应可表示为X+3Y![]() 2Z,其平衡常数为1600 C. 增大压强使平衡向生成Z的方向移动,平衡常数增大 D. 改变温度可以改变此反应的平衡常数
2Z,其平衡常数为1600 C. 增大压强使平衡向生成Z的方向移动,平衡常数增大 D. 改变温度可以改变此反应的平衡常数
【题目】—定温度下,向10mL0.40mol/LH2O2 溶液中加入少量FeCl3溶液(忽略整个过程中溶液体积的变化),不同时刻测得生成O2的体积(已折算为标准状况下)如表所示:
t/min | 0 | 2 | 4 | 6 |
V(O2)/mL | 0 | 9.9 | 17.5 | 22.4 |
资料显示,反应分两步进行:①2Fe3++H2O2=2Fe2++2H++O2;②H2O2+2Fe2++2H+=2H2O+2Fe3+。反应过程中能量变化如图所示。下列说法正确的是
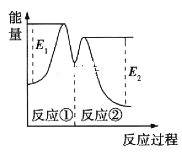
A. Fe2+的作用是增大过氧化氢的分解速率
B. 反应①、②均是放热反应
C. 反应2H2O2(aq)=2H2O(l)+O2(g)是吸热反应
D. 0~6min内的平均反应速率v(H2O2)=3.33×10-2mol/(L·min)