题目内容
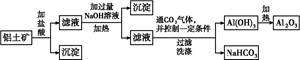
某研究小组将一批废弃的线路板经浓硝酸和稀硫酸处理后得到一混合溶液,其中含有Cu2+、Fe2+、Fe3+、Al3+等金属离子,并设计了以下两种流程以分别制取CuSO4·5H2O晶体和AlCl3
溶液: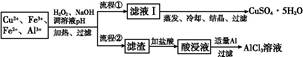
已知:相关金属离子开始沉淀至完全沉淀时的pH范围为:
| 离子 | Fe3+ | Fe2+ | Al3+ | Cu2+ |
| pH范围 | 2.2~3.2 | 5.5~9.0 | 4.1~5.0 | 5.3~6.6 |
(1)加入H2O2的作用是 ,欲使制取的CuSO4·5H2O晶体较为纯净,pH至少应调至 。
(2)写出H2O2与Fe2+反应的离子方程式: 。
(3)流程②中加入适量Al粉起的作用是 。
(4)根据你所学的化学知识,由AlCl3溶液(不添加其他化学试剂)能否制得无水AlCl3 (填“能”或“不能”),原因是 。
(5)取体积为V(L)的酸浸液,向其中滴加a mol·L-1的NaOH溶液,生成沉淀的物质的量与所加的NaOH溶液的体积(L)关系如图。请用V1、V2、V3表示所取的酸浸液中n(Fe3+)∶n(Al3+)= 。
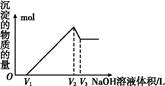
(1)将Fe2+氧化为Fe3+ 5.0
(2)2Fe2++H2O2+2H+ 2Fe3++2H2O
2Fe3++2H2O
(3)与酸浸液中Fe3+和H+反应生成Al3+
(4)不能 直接加热AlCl3溶液,会发生水解反应,最终得到氧化铝 (5)
解析

练习册系列答案
相关题目
工业上用粗氧化铜(含杂质FeO)为原料制取氯化铜晶体(CuCl2·2H2O)的生产流程如下: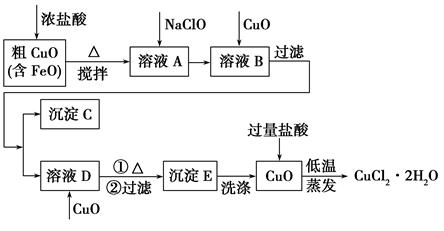
| 物质 | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
| 完全沉淀时的pH | ≥9.6 | ≥6.4 | 3~4 |
(2)沉淀C的化学式为________。
(3)实验室如何检验沉淀E已洗涤干净?________。
(4)低温蒸发的目的是______________________________________。
(5)流程中两次加入了CuO,而不是一次性向溶液B中加入过量的CuO,其理由是________________________________________________。
工业上以黄铜矿(主要成分是CuFeS2,杂质不溶于水和酸)为原料,制备蓝色晶体G,其化学式为[Cu(NH3)4]SO4·H2O,涉及流程如下: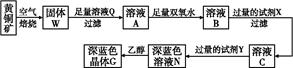
已知25 ℃时,几种金属氢氧化物的溶度积常数和完全沉淀的pH范围如下表:
| | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
| Ksp | 8.0×10-16 | 2.2×10-20 | 4.0×10-38 |
| 完全沉淀pH | ≥9.6 | ≥6.4 | ≥3.2 |
(1)加快黄铜矿焙烧速率,可采用的措施有 (写两种)。
(2)加入双氧水可能发生反应的离子方程式为 ;
试剂X的化学式为 。
(3)常温下,0.1 mol/L试剂Y的pH=11,则该温度下,试剂Y的电离常数为 ,用pH试纸测该溶液pH的方法是 。
(4)已知Cu(OH)2+4NH3·H2O
 [Cu(NH3)4]2++2OH-+4H2O,写出该反应的平衡常数表达式: 。
[Cu(NH3)4]2++2OH-+4H2O,写出该反应的平衡常数表达式: 。(5)在溶液N中加入乙醇的目的是 。
硝酸铝广泛用于有机合成、印染工业等。工业上以铝灰为原料(主要成分为Al,含少量Al2O3、Fe2O3、SiO2、CaO、MgO等)制备硝酸铝的工艺流程如下:
已知:Al(OH)3沉淀和溶解的pH如下表:
| Al(OH)3 | 开始沉淀 | 沉淀完全 | 沉淀开始溶解 | 沉淀溶解完全 |
| pH | 3.3 | 5.0 | 7.8 | 12.8 |
回答下列问题:
(1)碱溶时,发生主反应的离子方程式为________________________________。
(2)工艺流程中第一次加入硝酸调pH=7.0的目的是__________________________________________________________。
pH=7.0时,溶液中c(Al3+)=________(通常条件下,Ksp[Al(OH)3]=1.3×10-33)。
(3)若忽略杂质跟酸、碱的反应,则在碱溶、调pH=7.0、酸溶过程中,理论上消耗碱、酸的物质的量之比n1(NaOH)∶n2(HNO3)∶n3(HNO3)=________。
(4)现用1 t铝灰制硝酸铝晶体[Al(NO3)3·9H2O],最后生产出7.5 t硝酸铝晶体,若生产过程中铝元素的损失率为10%,计算铝灰中铝元素的质量分数。



 Fe2O3+SO2↑+SO3↑。
Fe2O3+SO2↑+SO3↑。