题目内容
将1 mol![]() 和3 mol
和3 mol![]() 充入一密闭容器中,使其在一定条件下达到平衡:
充入一密闭容器中,使其在一定条件下达到平衡:![]()
![]()
![]() ,下列哪一状态一定是平衡状态( )
,下列哪一状态一定是平衡状态( )
(1)混合气体的体积等于最初一半的状态;
(2)氮气、氢气和氨的总物质的量不随时间延长而改变的状态;
(3)氮气、氢气和氨的总质量不随时间延长而改变的状态;
(4)单位时间有1 mol氨消耗的同时,就有0.5 mol氮气生成的状态;
(5)单位时间有1 mol氨消耗的同时,有0.5 mol氮气和1.5 mol氢气生成氨的状态;
(6)氮气和氢气体积百分含量之比不随时间延长而改变的状态;
(7)氮气、氢气和氨三者的质量之比不随时间延长而改变的状态;
(8)正、逆反应同时进行的状态;
(9)氢气减少的速率等于氨增加的速率的状态;
(10)氮气、氢气和氨三者浓度相等的状态;
(11)外界条件的改变不影响组成分质量分数的状态;
(12)氨的生成速率与其消耗速率相等的状态.
提示:
(3)质量守恒是客观的,任何时刻总质量是恒等的;(4)氨的消耗速率和氮气的生成速率都是逆反应速率;(5)重点强调“0.5 mol氮气和1.5 mol氢气生成氨”的反应,事实上是正反应;(6)氮气和氢气初始体积比为1∶3,消耗量之比为1∶3,则平衡时的体积比必然是1∶3,所以氮气和氢气的体积分数之比保持不变;(10)三者浓度相等的状态,并不是说三者浓度保持不变的状态
|

(8分)甲醇是一种很好的燃料,工业上用CH4和H2O(g)为原料,通过反应I和II来制备甲醇。
请回答下列问题:
(1)将1.0molCH4和2.0molH2O(g)通入反应室(容积为l00L),在一定条件下发生反应:
cCH4(g)+H2O(g) CO(g)+3H2(g) I。
CO(g)+3H2(g) I。
CH4的转化率与温度、压强的关系如图所示。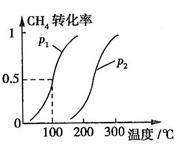
①已知100℃时达到平衡所需的时间为5min,则用H2表示的平均反应速率为
②图中的P1 P2(填“<”、“>”或“=”),100℃时平衡常数为 。
③该反应的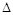 H 0。(填“<”、“>”或“=”)
H 0。(填“<”、“>”或“=”)
(2)在压强为0.1MPa条件下,a molCO与3a mol H2的混合气体在催化剂作用下能自发反应生成甲醇:CO(g)+2H2(g) CH30H(g)
CH30H(g)  H<0 Ⅱ。
H<0 Ⅱ。
①若容器容积不变,下列措施可增加甲醇产率的是 (填序号)。
| A.升高温度 | B.将CH3OH(g)从体系中分离 |
| C.充入He,使体系总压强增大 | D.再充人lmolCO和3 mol H2 |
| 实验编号 | T(℃) | n(CO)/n(H2) | p(MPa) |
| l | 150 | 1/3 | 0.1 |
| 2 | n | 1/3 | 5 |
| 3 | 350 | m | 5 |
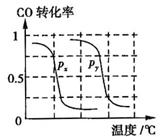
b.根据反应Ⅱ的特点,如图是在压强分别为0.1MPa和5MPa下CO的转化率随温度变化的曲线图,请指明图中的压强
 = MPa。
= MPa。
(8分)甲醇是一种很好的燃料,工业上用CH4和H2O(g)为原料,通过反应I和II来制备甲醇。
请回答下列问题:
(1)将1.0molCH4和2.0molH2O(g)通入反应室(容积为l00L),在一定条件下发生反应:
cCH4(g)+H2O(g)  CO(g)+3H2(g)
I。
CO(g)+3H2(g)
I。
CH4的转化率与温度、压强的关系如图所示。
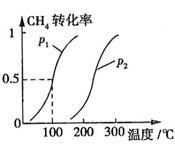
①已知100℃时达到平衡所需的时间为5min,则用H2表示的平均反应速率为
②图中的P1 P2(填“<”、“>”或“=”),100℃时平衡常数为 。
③该反应的 H
0。(填“<”、“>”或“=”)
H
0。(填“<”、“>”或“=”)
(2)在压强为0.1MPa条件下,a molCO与3a mol H2的混合气体在催化剂作用下能自发反应生成甲醇:CO(g)+2H2(g) CH30H(g)
CH30H(g)  H<0 Ⅱ。
H<0 Ⅱ。
①若容器容积不变,下列措施可增加甲醇产率的是 (填序号)。
A.升高温度 B.将CH3OH(g)从体系中分离
C.充入He,使体系总压强增大 D.再充人lmolCO和3 mol H2
②为了寻找合成甲醇的适宜温度和压强,某同学设计了三组实验,部分实验条件已经填在了下面的实验设计表中。
|
实验编号 |
T(℃) |
n(CO)/n(H2) |
p(MPa) |
|
l |
150 |
1/3 |
0.1 |
|
2 |
n |
1/3 |
5 |
|
3 |
350 |
m |
5 |
a.上表中剩余的实验条件数据:n= ,m= 。
b.根据反应Ⅱ的特点,如图是在压强分别为0.1MPa和5MPa下CO的转化率随温度变化的曲线图,请指明图中的压强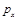 = MPa。
= MPa。


 R(g) + 2L(?) ,此反应规律符合下图图像。
R(g) + 2L(?) ,此反应规律符合下图图像。
 2NH3(g)
2NH3(g)  H=-92.4 kJ/mol,该反应的能量变化如图所示。
H=-92.4 kJ/mol,该反应的能量变化如图所示。