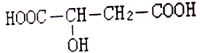题目内容
【题目】室温下,下列关于溶液中微粒的物质的量浓度关系的描述,不正确的是
A. 0.1mol·L-1HCl溶液与0.2mol·L-1NH3·H2O溶液等体积混合pH>7:c(NH3·H2O)>c(Cl-)> c(NH4+)> c(OH-)
B. pH=8的 NaClO2溶液中:c(Na+)>c(ClO2-)>c(OH-)>c(H+)
C. 向氨水中不断通入CO2,随着CO2的增加,![]() 不断减小
不断减小
D. CH3COOH与NaOH溶液发生中和反应,当醋酸过量时,溶液中可能存在:c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
【答案】A
【解析】A. 等浓度的一水合氨和氯化铵混合溶液中PH>7,一水合氨电离大于铵根离子水解;B. 强碱弱酸盐,水解显碱性;C.![]() =
=![]() ,随CO2的增多,c(NH4+)增大;D. 醋酸钠和醋酸等量时,醋酸的电离大于醋酸根离子的水解,溶液显酸性;
,随CO2的增多,c(NH4+)增大;D. 醋酸钠和醋酸等量时,醋酸的电离大于醋酸根离子的水解,溶液显酸性;
A.0.1molL-1HCl溶液与0.2molL-1氨水等体积混合得到等浓度的一水合氨和氯化铵混合溶液,溶液PH>7说明一水合氨电离大于铵根离子水解,c(NH4+)>c(Cl-)>c(NH3H2O)>c(OH-),故A错误;B. NaClO2为强碱弱酸盐,水解显碱性,c(Na+)>c(ClO2-)>c(OH-)>c(H+),故B正确;C.![]() =
=![]() ,向氨水中不断通入CO2,随着CO2的增加,c(NH4+)不断增大,
,向氨水中不断通入CO2,随着CO2的增加,c(NH4+)不断增大,![]() 不断减小,C正确;D. 若醋酸过量,反应后溶液中的溶质为醋酸钠和醋酸,醋酸的电离大于醋酸根离子的水解,溶液显酸性,并由化学式可知,c(CH3COO-)>c(Na+)>c(H+)>c(OH-),D正确;答案选A.
不断减小,C正确;D. 若醋酸过量,反应后溶液中的溶质为醋酸钠和醋酸,醋酸的电离大于醋酸根离子的水解,溶液显酸性,并由化学式可知,c(CH3COO-)>c(Na+)>c(H+)>c(OH-),D正确;答案选A.

练习册系列答案
相关题目