题目内容
12.下列反应的离子方程式正确的是( )| A. | 向明矾溶液中加入足量的烧碱溶液:Al3++3OH-=Al(OH)3↓ | |
| B. | 在含有等物质的量的Fe(NO3)2和KI组成的混合溶液中滴入稀盐酸:3Fe2++4H++NO3-=3Fe3++NO↑+2H2O | |
| C. | 碳酸氢铵溶液中滴加足量的NaOH溶液:HCO3-+OH-=CO32-+H2O | |
| D. | 纯碱溶液呈碱性的原因:CO32-+H2O?HCO3-+OH- |
分析 A.氢氧化钠足量反应生成偏铝酸钠;
B.碘离子的还原性强于二价铁离子,硝酸根在酸性环境下先氧化碘离子;
C.氢氧化钠足量,氨根离子、碳酸氢根离子都反应;
D.碳酸根为多元弱酸根离子,分步水解.
解答 解:A.向明矾溶液中加入足量的烧碱溶液,离子方程式:Al3++4OH-=AlO2-+2H2O,故A错误;
B.在含有等物质的量的Fe(NO3)2和KI组成的混合溶液中滴入稀盐酸,离子方程式:2NO3-+6I-+8H+=3I2+2NO↑+4H2O,故B错误;
C.碳酸氢铵溶液中滴加足量的NaOH溶液,离子方程式:NH4++HCO3-+2OH-=CO32-+H2O+NH3•H2O,故C错误;
D.纯碱溶液呈碱性是因为碳酸根离子水解生成碳酸氢根离子与氢氧根离子,离子方程式:CO32-+H2O?HCO3-+OH-,故D正确;
故选:D.
点评 本题考查了离子方程式的书写,明确反应实质是解题关键,注意离子还原性强弱与反应先后顺序,题目难度不大.

练习册系列答案
 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案
相关题目
2.常温时在指定条件下的溶液中,下列各组粒子一定能大量共存的是( )
| A. | 加入Na2O2后的溶液中:K+、AlO2-、NO3-、SO32- | |
| B. | 水电离的c(H+ )=1×10-13 mol•L-1的溶液中:Fe2+、Mg 2+、SO42-、NO3- | |
| C. | 通入足量SO2后的溶液中:Ba2+、Fe2+、H2SO3、Cl- | |
| D. | 0.1mol•L-1 KMnO4酸性溶液中:H2O2、NH4+、Br2、SO4 2- |
20. 天然气含有硫化氢气体,回收并综合利用硫化氢有重要的经济价值和环境保护意义.如硫化氢可经过一系列反应制得硫酸:
天然气含有硫化氢气体,回收并综合利用硫化氢有重要的经济价值和环境保护意义.如硫化氢可经过一系列反应制得硫酸:
H2S$→_{点燃}^{O_{2}}$SO2$\stackrel{H_{2}O}{→}$H2SO3$\stackrel{氧化}{→}$H2SO4
(1)物质发生不完全燃烧时的反应热难以通过实验测得.已知硫化氢气体的燃烧热是586kJ/mol,固体硫单质的燃烧热是297 kJ•mol-1.写出硫化氢气体不完全燃烧生成固体硫单质的热化学方程式H2S(g)+$\frac{1}{2}$O2(g)=S(s)+H2O (l)△H=-279kJ/mol.
(2)工业生产中硫化氢尾气可用NaOH溶液吸收.
①吸收尾气后得到的Na2S溶液显碱性(填“酸”、“碱”、“中”);
②下列与H2S、NaHS和Na2S相关的离子方程式正确的是(填字母序号)AC.
A.H2S+OH-=HS-+H2O
B.HS-+H2O=H2S+OH-
C.HS-+H2O?S2-+H3O+
D.S2-+H2O?H2S+2OH-
(3)在一定温度下,某容器中发生2H2S(g)?2H2(g)+S2(g)的反应,测得相应时间时部分物质的浓度(mol•L-1)如下表,根据表中数据回答问题:
①判断90min时反应速率v(正)= v(逆)(填“>”、“=”或“<”);
②求该温度下反应的化学平衡常数(不必写出计算过程)K=0.0025 mol•L-1.
(4)以硫化氢为原料,使用质子固体电解质(能传导H+)构成燃料电池,硫化氢放电后生成硫蒸气(化学式S2),该燃料电池的负极反应式为2H2S-4e-=S2+4H+.
(5)硫酸是强酸,在图中画出硫酸溶液和氢氧化钠溶液反应过程的能量变化示意图.
 天然气含有硫化氢气体,回收并综合利用硫化氢有重要的经济价值和环境保护意义.如硫化氢可经过一系列反应制得硫酸:
天然气含有硫化氢气体,回收并综合利用硫化氢有重要的经济价值和环境保护意义.如硫化氢可经过一系列反应制得硫酸:H2S$→_{点燃}^{O_{2}}$SO2$\stackrel{H_{2}O}{→}$H2SO3$\stackrel{氧化}{→}$H2SO4
(1)物质发生不完全燃烧时的反应热难以通过实验测得.已知硫化氢气体的燃烧热是586kJ/mol,固体硫单质的燃烧热是297 kJ•mol-1.写出硫化氢气体不完全燃烧生成固体硫单质的热化学方程式H2S(g)+$\frac{1}{2}$O2(g)=S(s)+H2O (l)△H=-279kJ/mol.
(2)工业生产中硫化氢尾气可用NaOH溶液吸收.
①吸收尾气后得到的Na2S溶液显碱性(填“酸”、“碱”、“中”);
②下列与H2S、NaHS和Na2S相关的离子方程式正确的是(填字母序号)AC.
A.H2S+OH-=HS-+H2O
B.HS-+H2O=H2S+OH-
C.HS-+H2O?S2-+H3O+
D.S2-+H2O?H2S+2OH-
(3)在一定温度下,某容器中发生2H2S(g)?2H2(g)+S2(g)的反应,测得相应时间时部分物质的浓度(mol•L-1)如下表,根据表中数据回答问题:
时间 物质 | 0min | 20min | 60min | 90min | 120min |
| H2S | 0.006 | 0.005 | |||
| H2 | 0 | 0.002 | 0.004 | ||
| S2 | 0 | 0.002 | 0.0025 |
②求该温度下反应的化学平衡常数(不必写出计算过程)K=0.0025 mol•L-1.
(4)以硫化氢为原料,使用质子固体电解质(能传导H+)构成燃料电池,硫化氢放电后生成硫蒸气(化学式S2),该燃料电池的负极反应式为2H2S-4e-=S2+4H+.
(5)硫酸是强酸,在图中画出硫酸溶液和氢氧化钠溶液反应过程的能量变化示意图.
4.以葡萄糖为燃料的微生物燃料电池结构如图所示.关于该电池的叙述正确的是( )
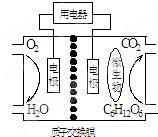

| A. | 该电池能够在高温下工作 | |
| B. | 电池的负极反应为:C6H12O6+6H2O-24e-=6CO2↑+24H+ | |
| C. | 放电过程中,H+从正极区向负极区迁移 | |
| D. | 在电池反应中,每消耗1mol氧气,理论上能生成标准状况下气体$\frac{2.42}{6}$L |
2.下列关于有机化合物的说法不正确的是( )
| A. | 用四氯化碳可以萃取乙酸水溶液中的乙酸 | |
| B. | 丁烷有两种同分异构体 | |
| C. | 乙烯可以与氢气发生加成反应,也可发生自身加聚反应生成聚乙烯 | |
| D. | 纤维素、淀粉和蛋白质都是高分子化合物 |


 ;
; ;
;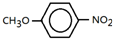 .
.

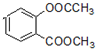 +3NaOH→CH3COONa+CH3OH+
+3NaOH→CH3COONa+CH3OH+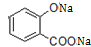 +H2O.
+H2O.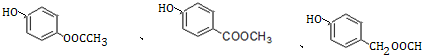 (写出其中一种的结构简式).
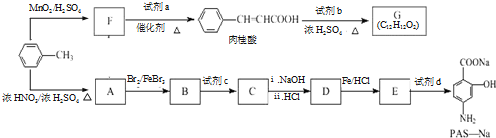
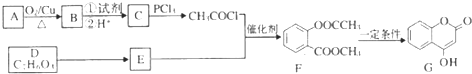
(写出其中一种的结构简式).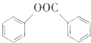 )是一种重要的有机合成中间体,试写出以苯、甲苯为原料制取该化合物的合成路线流程图(无机原料任用)
)是一种重要的有机合成中间体,试写出以苯、甲苯为原料制取该化合物的合成路线流程图(无机原料任用)