题目内容
17.下列电池工作时,O2在正极放电的是( )| A. |  锌锰电池 | B. |  铅蓄电池 | C. |  太阳能电池 | D. |  氢燃料电池 |
分析 电池工作时,O2在正极放电,则正极上氧气得到电子,发生O2+4H++4e-=2H2O或O2+2H2O+4e-=4OH-,为燃料电池,以此来解答.
解答 解:A.锌锰干电池中电极反应式,负极反应为Zn-2e-═Zn2+,正极反应为2MnO2+2NH4++2e-=Mn2O3+2NH3+H2O,所以不符合题意,故A错误;
B.铅蓄电池放电时负极电极反应为Pb-2e-+SO42-=PbSO4 ,正极电极反应为PbO2+2e-+4H++SO42-=PbSO4+2H2O,所以不符合题意,故B错误;
C.太阳能电池是将太阳能转化为电能,所以不符合题意,故C错误;
D.酸性氢氧燃料电池电极反应式为2H2-4e-=4H+、O2+4H++4e-=2H2O,碱性氢氧燃料电池电极反应式为2H2-4e-+4OH-=4H2O、O2+2H2O+4e-=4OH-,所以符合题意,故D正确;
故选D.
点评 本题考查原电池原理,把握正负极上发生的反应是解本题关键,难点是电极反应式的书写,要结合电解质溶液酸碱性书写,题目难度中等.

练习册系列答案
相关题目
8.下列说法正确的是( )
| A. | 所有的酸和碱都能使指示剂变色 | |
| B. | 物质发生缓慢氧化时一定放出热量 | |
| C. | 检测某溶液的pH时,pH试纸要预先用水湿润 | |
| D. | 一氧化碳还原氧化铜后试管壁上留下的红色物质,用稀硫酸浸泡除去 |
9. 如图为元紊周期表中短周期非金属元素,W原子最外层电子数是其电子层数的2倍,下列说法不正确的是( )
如图为元紊周期表中短周期非金属元素,W原子最外层电子数是其电子层数的2倍,下列说法不正确的是( )
 如图为元紊周期表中短周期非金属元素,W原子最外层电子数是其电子层数的2倍,下列说法不正确的是( )
如图为元紊周期表中短周期非金属元素,W原子最外层电子数是其电子层数的2倍,下列说法不正确的是( )| A. | 原子半径Y>Z | B. | WZ2能使酸性高锰酸钾溶液褪色 | ||
| C. | X的氢化物比Y的氢化物稳定 | D. | W元素氧化物的水化物一定是强酸 |
5. 中和热的测定是高中重要的定量实验.取0.55mol/L的NaOH溶液50mL与0.25mol/L的硫酸50mL置于如图所示的装置中进行中和热的测定实验,回答下列问题:
中和热的测定是高中重要的定量实验.取0.55mol/L的NaOH溶液50mL与0.25mol/L的硫酸50mL置于如图所示的装置中进行中和热的测定实验,回答下列问题:
(1)从如图实验装置看,其中尚缺少的一种玻璃用品是环形玻璃搅拌器,除此之外,装置中的一个明显错误是大烧杯杯口与小烧杯杯口没有相平.
(2)若改用60mL 0.25mol•L-1H2SO4和50mL 0.55mol•L-1NaOH溶液进行反应与上述实验相比,所放出的热量不相等(填“相等”、“不相等”),若实验操作均正确,则所求中和热相等(填“相等”“不相等”).
(3)实验数据如表:
①请填写如表中的空白:
②近似认为0.55mol/L NaOH溶液和0.25mol/L硫酸溶液的密度都是1g/cm3,中和后生成溶液的比热容c=4.18J/(g•℃).则中和热△H=-56.8 kJ/mol (取小数点后一位).
 中和热的测定是高中重要的定量实验.取0.55mol/L的NaOH溶液50mL与0.25mol/L的硫酸50mL置于如图所示的装置中进行中和热的测定实验,回答下列问题:
中和热的测定是高中重要的定量实验.取0.55mol/L的NaOH溶液50mL与0.25mol/L的硫酸50mL置于如图所示的装置中进行中和热的测定实验,回答下列问题:(1)从如图实验装置看,其中尚缺少的一种玻璃用品是环形玻璃搅拌器,除此之外,装置中的一个明显错误是大烧杯杯口与小烧杯杯口没有相平.
(2)若改用60mL 0.25mol•L-1H2SO4和50mL 0.55mol•L-1NaOH溶液进行反应与上述实验相比,所放出的热量不相等(填“相等”、“不相等”),若实验操作均正确,则所求中和热相等(填“相等”“不相等”).
(3)实验数据如表:
①请填写如表中的空白:
| 温度 实验次数 | 起始温度t1℃ | 终止温度t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 29.5 | 3.4 |
| 2 | 27.0 | 27.4 | 27.2 | 32.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.2 | |
| 4 | 26.4 | 26.2 | 26.3 | 29.8 | |
12.共价键的极性随共用电子对偏移程度的增大而增强.下列分子中存在的化学键的极性最强的是( )
| A. | HF | B. | HCl | C. | HBr | D. | HI |
9.将2.06g NaBr和0.42g NaF溶于水形成混合溶液,加足量的AgNO3溶液得到沉淀,下面叙述正确的是( )
| A. | 溴化钠只有一部分反应,氟化钠未反应 | |
| B. | 氟化银溶于水 | |
| C. | 沉淀是氟化银 | |
| D. | 沉淀是氟化银与溴化银的混合物 |
6.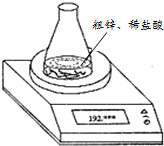 实验室制取氢气所用粗锌中多含有杂质铜,某小组同学利用如图装置测定粗锌中锌的质量分数,每隔相同时间读得电子天平的数据如表:(已知粗锌质量为1.950g、锥形瓶和稀盐酸的质量为190.720g)
实验室制取氢气所用粗锌中多含有杂质铜,某小组同学利用如图装置测定粗锌中锌的质量分数,每隔相同时间读得电子天平的数据如表:(已知粗锌质量为1.950g、锥形瓶和稀盐酸的质量为190.720g)
(1)写出锌和盐酸反应的化学方程式Zn+2HCl→ZnCl2+H2↑.
(2)不必作第6次读数的原因是第五次数据已达恒重,说明反应完全了.计算粗锌的质量分数时,需用到的数据有试样质量(或1.950 g)、锥形瓶加盐酸的质量(或190.720 g)、第4(或5)次读数(或192.610 g).
(3)数据处理结束后,同学们发现他们的测定结果明显偏大(填偏大、偏小或不变).他们在锥形瓶上增加一个装有碱石灰的干燥管后,再次实验,得到了较正确的结果.干燥管的作用有吸收水蒸气、吸收氯化氢气体.
 实验室制取氢气所用粗锌中多含有杂质铜,某小组同学利用如图装置测定粗锌中锌的质量分数,每隔相同时间读得电子天平的数据如表:(已知粗锌质量为1.950g、锥形瓶和稀盐酸的质量为190.720g)
实验室制取氢气所用粗锌中多含有杂质铜,某小组同学利用如图装置测定粗锌中锌的质量分数,每隔相同时间读得电子天平的数据如表:(已知粗锌质量为1.950g、锥形瓶和稀盐酸的质量为190.720g)| 读数次数 | 质量(g) | |
| 锥形瓶 + 稀盐酸 + 粗锌 | 第1次 | 192.655 |
| 第2次 | 192.636 | |
| 第3次 | 192.620 | |
| 第4次 | 192.610 | |
| 第5次 | 192.610 |
(2)不必作第6次读数的原因是第五次数据已达恒重,说明反应完全了.计算粗锌的质量分数时,需用到的数据有试样质量(或1.950 g)、锥形瓶加盐酸的质量(或190.720 g)、第4(或5)次读数(或192.610 g).
(3)数据处理结束后,同学们发现他们的测定结果明显偏大(填偏大、偏小或不变).他们在锥形瓶上增加一个装有碱石灰的干燥管后,再次实验,得到了较正确的结果.干燥管的作用有吸收水蒸气、吸收氯化氢气体.
7.设nA为阿伏加德罗常数的数值,下列说法正确的是(相对原子质量:H 1,N 14)( )
| A. | 1.8g的NH4+离子中含有nA个电子 | |
| B. | 标准状况下,22.4L水中含有nA个H2O分子 | |
| C. | 常温常压下,33.6 L Cl2中含有1.5nA个C12分子 | |
| D. | 1L1 mol•L-1 Na2 CO3溶液中有2nA个Na+和nA个CO32- |
 .氟元素最低负化合价为-1 价.
.氟元素最低负化合价为-1 价. .
.