题目内容
有一硝酸盐晶体,其化学式表示为M(NO3)x·nH2O,经测定其摩尔质量为242 g·mol-1.取1.21 g该晶体溶于水配成100 mL溶液,将此溶液倒入如图所示装置中,用石墨作电极进行电解.当有0.01 mol电子通过电极时,溶液中的金属阳离子全部析出,在A极得到金属0.32 g.
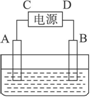
完成下列问题:
(1)金属M的相对原子质量为________,x=________,n=________.
(2)C极为________极.
(3)电解后溶液的H+浓度为(设电解前后溶液的体积不变________.
解析:
|
答案:(1)64 2 3 (2)负 (3)0.1 mol·L-1 思路解析:本题考查电解原理和相关计算. (1)先求化合价+x. 金属的物质的量为1.21÷242=0.005(mol),0.005×x=0.01,可求得x=2; 再求M的相对原子质量,0.005×M=0.32,可求得M=64; 再利用硝酸盐晶体的摩尔质量求n:64+2×62+18n=242可顺利求得n=3. (2)A极析出铜,发生还原反应,为阴极,可推知C极为电源负极. (3)方法1:利用析出的金属 2Cu(NO3)2+4H2O 2×64 g 4 mol 0.32 g y mol 2×64 g/0.32 g=4 mol/y mol,可求得y=0.01 mol,所以c(H+)=0.01 mol/0.1 L=0.1 mol·L-1. 方法2:利用电子转移
由电解的方程式可知,每转移1 mol电子,相应产生1 mol HNO3.那么有0.01 mol电子通过电极时,产生的HNO3是0.01 mol,所以c(H+)=0.01 mol/0.1 L=0.1 mol·L-1. |

 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案 全程金卷系列答案
全程金卷系列答案 有一硝酸盐晶体,其化学式表示为M(NO3)x?nH2O经测定其摩尔质量为242g?mol-1.取1.21g该晶体溶于水配成100mL溶液.将此溶液倒入右图所示装置中,用石墨作电极进行电解.当有0.01mol电子通过电极时,溶液中的金属阳离子全部析出,在A极得到金属0.32g.回答:
有一硝酸盐晶体,其化学式表示为M(NO3)x?nH2O经测定其摩尔质量为242g?mol-1.取1.21g该晶体溶于水配成100mL溶液.将此溶液倒入右图所示装置中,用石墨作电极进行电解.当有0.01mol电子通过电极时,溶液中的金属阳离子全部析出,在A极得到金属0.32g.回答: