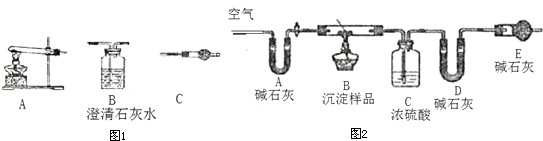
题目内容
某研究性学习小组将一定浓度的Na2CO3溶液滴入CuSO4溶液中得到蓝色沉淀.
甲同学认为沉淀可能是CuCO3;
乙同学认为沉淀可能是Cu(OH)2;
丙同学认为沉淀可能是CuCO3和Cu(OH)2的混合物.(查阅资料知:CuCO3和Cu(OH)2均不带结晶水)
Ⅰ.按照甲同学的观点,发生反应的离子反应方程式为________;
在探究沉淀成分前,须将沉淀从溶液中分离并净化.其具体操作依次为________;
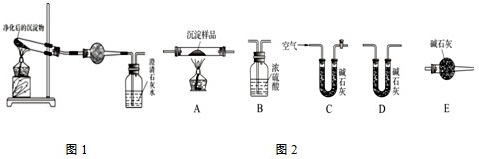
Ⅱ.请用下图所示装置,选择必要的试剂,定性探究生成物的成分.
(1)各装置连接顺序为________;
(2)能证明生成物中有CuCO3的实验现象是________.
Ⅲ.若CuCO3和Cu(OH)2两者都有,可利用下列装置通过实验测定其组成.
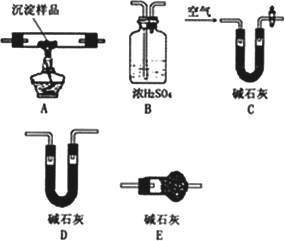
(1)装置C中碱石灰的作用是________,实验开始和结束时都要通入过量的空气,请说明结束时通入过量空气的作用是________
(2)若沉淀样品的质量为m克,装置B质量增加了n克,则沉淀中CuCO3的质量分数为________.
答案:
解析:
解析:
|
Ⅰ.Cu2++CO32-=CuCO3↓; 过滤、洗涤、干燥; Ⅱ.(1)ACB; (2)B中澄清的石灰水变浑浊. Ⅲ.(1)除去空气中的CO2和水蒸气; 将滞留在装置中的CO2和水蒸气排尽. (2)1-(49n/9m). |

练习册系列答案
 天天向上口算本系列答案
天天向上口算本系列答案
相关题目

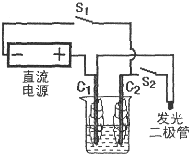 燃料电池是一种将化学反应产生的能量直接转换成电能的装置.某研究性学习小组在一次活动中,参照下图组装实验装置,以外面缠绕棉花的碳棒为电极,电解质溶液用0.5mol?L-1Na2SO4溶液,电源用3~6V直流电源,发光二极管起辉电压为1.7V,电流为0.6mA.
燃料电池是一种将化学反应产生的能量直接转换成电能的装置.某研究性学习小组在一次活动中,参照下图组装实验装置,以外面缠绕棉花的碳棒为电极,电解质溶液用0.5mol?L-1Na2SO4溶液,电源用3~6V直流电源,发光二极管起辉电压为1.7V,电流为0.6mA.