题目内容
【题目】某小组同学在学习了氨的性质后讨论:运用类比的思想,既然氨气具有还原性,能否像H2那样还原CuO呢?他们设计实验制取氨气并探究上述问题:
(一)制取氨气
(1)写出实验制取氨气的化学方程式;
(2)有同学模仿排饱和食盐水收集氯气的方法,想用排饱和氯化铵溶液的方法收集氨气。你认为他能否达到目的?(填“能”或“否”),理由是。
(3)(二)该小组中某同学设计了如下实验装置(夹持及尾气入理装置未画出),探究氨气的还原性: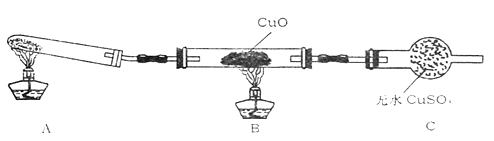
该装置在设计上有一定缺陷,为保证实验结果的准确性,对该装置的改进措施是。
(4)利用改进后的装置进行实验,观察到CuO变为红色物质,无水CuSO4变蓝色,同时生成一种无污染的气体。写出氨气与CuO反应的化学方程式。
【答案】
(1)2NH4Cl+Ca(OH)2 ![]() CaCl2+2NH3↑+2H2O
CaCl2+2NH3↑+2H2O
(2)否,氨气极易溶于水、氯化铵对氨气在水中的溶解影响不大
(3)在装置A与B之间增加装有碱石灰的干燥管
(4)3CuO+2NH3 ![]() 3Cu+N2+3H2O。
3Cu+N2+3H2O。
【解析】解:(一)(1)实验室制取氨气,常用氯化铵和氢氧化钙固体,因此反应方程式为2NH4Cl+Ca(OH)2 ![]() CaCl2+2NH3↑+2H2O;
CaCl2+2NH3↑+2H2O;
(2)因为氨气极易溶于水,且氯化铵对氨气在水中的溶解度影响不大,即不能用排饱和氯化铵溶液收集氨气;
(二)(3)制备的氨气中混有水蒸气,对硫酸铜检验B装置中生成水蒸气,产生干扰,因此应在A和B之间增加一个盛有碱石灰的干燥管;
(4)有红色物质,即生成铜单质,无水硫酸铜变蓝,说明产生水蒸气,无污染的气体为N2,因此反应方程式为3CuO+2NH3 ![]() 3Cu+N2+3H2O。
3Cu+N2+3H2O。
【考点精析】认真审题,首先需要了解氨的化学性质(与水反应,NH3是惟一能使润湿的红色石蕊试纸交蓝的气体,常用此性质检验NH3;与酸反应:NH3+HCl=NH4Cl(生成白烟);与O2反应:4NH3+5O2=4NO+6H2O+Q;

 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案【题目】下列实验操作说法正确的是( )
选项 | 实验操作 | 现象与结论(或装置用途) |
A | 某溶液加入浓NaOH溶液加热,在试管口放一片湿润的红色石蕊试纸 | 试纸变蓝,说明NH3是碱 |
B |
| 可以用于比较Fe3+、I2、Cl2的氧化性强弱 |
C | 2mL 2% CuSO4中加4~6滴2% NaOH溶液,振荡后加入0.5mL X溶液,加热煮沸 | 未出现砖红色沉淀,说明X不含有醛基 |
D |
| 用于吸收HCl气体能防倒吸 |
A.A
B.B
C.C
D.D
【题目】常温下,向某Ba(OH)2溶液中逐滴加入pH=x的盐酸,测得混合溶液的部分pH如表所示:
序号 | 氢氧化钡溶液的体积/mL | 盐酸的体积/mL | 溶液的pH |
① | 22.00 | 0.00 | 13 |
② | 22.00 | 18.00 | 12 |
③ | 22.00 | 22.00 | 7 |
(1)Ba(OH)2溶液的物质的量浓度为?
(2)x的值是多少?
(3)向100mL上述Ba(OH)2溶液中逐滴加入0.05mol/L NaHCO3溶液,当沉淀刚好达最大值时溶液的pH为多少?(已知lg2=0.3)