题目内容
【题目】碳及其化合物在工农业上有重要作用。
Ⅰ、在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g) ![]() CO(g)+H2O(g),其化学平衡常数K和温度T的关系如表所示:
CO(g)+H2O(g),其化学平衡常数K和温度T的关系如表所示:
T/℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K=___________。该反应为__________(填“吸热”或“放热”)反应。
(2)某温度下平衡浓度符合下式: c(CO2)·c(H2)=c(CO)·c(H2O),该温度下加入1 mol CO2(g)和1 mol H2(g),充分反应,达到平衡时,CO2的转化率为______________。
(3)在800 ℃时发生上述反应,某时刻测得容器内各物质的浓度分别为c(CO2)为2 mol/L,c(H2)为1.5 mol/L,c(CO)为1 mol/L,c(H2O)为3 mol/L,则正、逆反应速率的比较为:v正___________v逆(填“>”“<”或“=”)。
Ⅱ、工业上用CO2和H2反应合成甲醚。已知:
CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H1=-53.7kJmol-1
CH3OCH3(g)+H2O(g)═2CH3OH(g)△H2=+23.4kJmol-1
则2CO2(g)+6H2(g)![]() CH3OCH3(g)+3H2O(g)△H3=_______________kJ·mol-1。
CH3OCH3(g)+3H2O(g)△H3=_______________kJ·mol-1。
Ⅲ、常温下用氨水吸收CO2可得到NH4HCO3溶液,在该溶液中,c(NH4+)________(填“>”、“<”或“=”)c(HCO3—);反应NH4++HCO3—+H2O![]() NH3·H2O+H2CO3的平衡常数K=__________。(已知常温下NH3·H2O的电离平衡常数Kb=2×10-5,H2CO3的电离平衡常数K1=4×10-7,K2
NH3·H2O+H2CO3的平衡常数K=__________。(已知常温下NH3·H2O的电离平衡常数Kb=2×10-5,H2CO3的电离平衡常数K1=4×10-7,K2
【答案】 ![]() 吸热 50% < -130.8 > 1.25×10-3
吸热 50% < -130.8 > 1.25×10-3
【解析】Ⅰ、(1)CO2(g)+H2(g)CO(g)+H2O(g)的平衡常数表达式K=![]() ,由表中数据可知,升高温度,平衡常数增大,说明升高温度,平衡正向移动,故正反应为吸热反应,故答案为:
,由表中数据可知,升高温度,平衡常数增大,说明升高温度,平衡正向移动,故正反应为吸热反应,故答案为: ![]() ;吸热;
;吸热;
(2)某温度下,平衡浓度符合下式:c(CO2)c(H2)=c(CO)c(H2O),说明平衡常数K=1,故温度为830℃;CO2、H2的起始物质的量之比等于化学计量数之比,则二者平衡浓度相等,由CO2(g)+H2(g)CO(g)+H2O(g),可知平衡时CO(g)、H2O(g)浓度相等,结合平衡常数K=![]() =1,可知平衡时c(CO2)=c(H2)=c(CO)=c(H2O),根据碳元素守恒可知,平衡时n(CO2)=n(CO2)=
=1,可知平衡时c(CO2)=c(H2)=c(CO)=c(H2O),根据碳元素守恒可知,平衡时n(CO2)=n(CO2)= ![]() =0.5mol,故二氧化碳的转化率为
=0.5mol,故二氧化碳的转化率为![]() ×100%=50%,故答案为:50%;
×100%=50%,故答案为:50%;
(3)此时浓度商Qc=![]() =1>800℃时平衡常数K=0.9,反应向逆反应方向移动,则v(正)<v(逆),故答案为:<;
=1>800℃时平衡常数K=0.9,反应向逆反应方向移动,则v(正)<v(逆),故答案为:<;
Ⅱ、已知:①CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H1=-53.7kJmol-1,②CH3OCH3(g)+H2O(g) ═2CH3OH(g)△H2=+23.4kJmol-1,根据盖斯定律,①×2-②可得:2CO2(g)+6H2(g) CH3OCH3(g) +3H2O(g),△H3=2△H1-△H2=2×(-53.7kJmol-1)-23.4kJmol-1 =-130.8kJmol-1,故答案为:-130.8;
Ⅲ、根据盐类水解规律,已知NH3·H2O的电离平衡常数K=2×10-5,H2CO3的电离平衡常数K1=4×10-7,K2=4×10-11,所以碳酸氢根的水解程度更大,所以NH4HCO3显碱性;在NH4HCO3溶液中,c(NH4+)>c(HCO3-);反应NH4++HCO3-+H2O![]() NH3·H2O+H2CO3的平衡常数K=
NH3·H2O+H2CO3的平衡常数K= =
=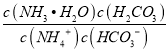 ×
×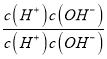 =
=![]() =
=![]() =1.25×10-3,故答案为:>; 1.25×10-3。
=1.25×10-3,故答案为:>; 1.25×10-3。