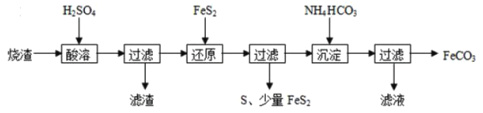
题目内容
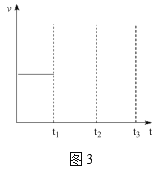
【题目】向10 mL某浓度的AlCl3溶液中滴加1.5 mol·L-1的NaOH溶液时,得到Al(OH)3沉淀的质量(g)与所滴加NaOH溶液的体积(mL)关系如图所示,试回答下列问题:
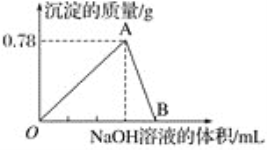
(1)图中B点溶液中的溶质有________________。
(2)O点到B点反应的总离子方程式可表示为________________。
(3)反应至A点时消耗NaOH溶液的体积为______________。
(4)AlCl3溶液的浓度为______________。
【答案】NaAlO2、NaCl Al3++4OH-=![]() +2H2O 20 mL 1 mol·L-1
+2H2O 20 mL 1 mol·L-1
【解析】
根据图像发生的离子方程式为Al3++3OH-=Al(OH)3↓、Al(OH)3+OH-=AlO2-+2H2O,据此分析解答。
(1)根据图像发生的离子方程式为Al3++3OH-=Al(OH)3↓、Al(OH)3+OH-=AlO2-+2H2O,B点溶质为NaCl、NaAlO2;
(2)根据(1),O点到B点总反应的离子方程式为Al3++4OH-=AlO2-+2H2O;
(3)OA点发生:Al3++3OH-=Al(OH)3↓,根据图像,得到Al(OH)3的质量为0.78g,物质的量为0.01mol,根据反应方程式,消耗NaOH的物质的量为0.03mol,即消耗NaOH的体积为![]() =0.02L,应为20mL;
=0.02L,应为20mL;
(4)利用元素守恒,n(AlCl3)=n[Al(OH)3]=0.01mol,则c(AlCl3)=![]() =1mol·L-1。
=1mol·L-1。

 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案【题目】CO2是一种温室气体,对人类的生存环境产生巨大的影响,维持大气中CO2的平衡对生态环境保护有着重要意义。
(1)CO2加氢合成低碳烯烃技术能有效利用CO2,以合成C2H4为例。该转化分为两步进行:
第一步:CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH1=+41.3kJ/mol
CO(g)+H2O(g) ΔH1=+41.3kJ/mol
第二步:2CO(g)+4H2(g)![]() C2H4(g)+2H2O(g) ΔH2=-210.5kJ/mol
C2H4(g)+2H2O(g) ΔH2=-210.5kJ/mol
CO2加氢合成乙烯的热化学方程式为__。
(2)利用CO2和H2合成甲醇又是一个有效利用CO2的途径,反应如下:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH3
CH3OH(g)+H2O(g) ΔH3
①在容积为2L的恒容密闭容器中,通入2molCO2和3molH2发生上述反应,下列说法能够表明该可逆反应达到平衡状态的是__(填字母)
a.消耗1.5molH2时,有0.5molCH3OH生成
b.转移3mol电子时,消耗11.2L(标准状况下)CO2
c.体系中气体的密度不变
d.水蒸气的体积分数保持不变
e.单位时间内生成H2与生成H2O的物质的量之比为3:1
②研究温度对该反应甲醇产率的影响。在210℃~290℃,保持原料气中CO2和H2的投料比不变,按一定流速发生上述反应。得到甲醇平衡产率与温度的关系如图所示,ΔH3__0(填“>”、“=”或“<”)。判断依据是__。
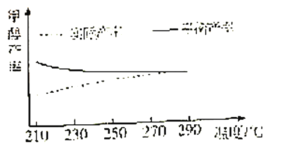
③在一固定容积的密闭容器中发生上述反应。若要提高平衡时CH3OH产率,则可以采取的措施是__(填字母)。
a.升温 b.加入催化剂 c.增加CO2的浓度 d.加入H2加压 e.加入惰性气体 f.分离出甲醇
(3)在一定温度和催化剂作用下,也可将CO2转化为燃料CH4,反应方程式为CO2(g)+4H2(g)![]() CH4(g)+2H2O(g)。当30℃时,一定量的CO2和H2混合气体在容积为1L的恒容密闭容器中发生上述反应,5min后达到半衡,此时各物质的浓度如下表:
CH4(g)+2H2O(g)。当30℃时,一定量的CO2和H2混合气体在容积为1L的恒容密闭容器中发生上述反应,5min后达到半衡,此时各物质的浓度如下表:
物质 | CO2(g) | H2(g) | CH4(g) | H2O(g) |
浓度/mol·L-1 | 0.2 | 0. | a | 1.6 |
则a=__,该反应平衡常数K=__。
(4)以TiO2/Cu2Al2O4为催化剂,利用CH4可以将CO2直接转化成乙酸。在不同温度下催化剂的催化效率与乙酸的生成速率的关系如图所示,乙酸的生成速率主要取决于温度影响的范围是__。250~300℃时,温度升高而乙酸的生成速率降低的原因是__。