题目内容
除去CO2中的少量SO2,应选用下列试剂中的
- A.亚硫酸钠溶液
- B.碳酸氢钠饱和溶液
- C.氢氧化钠溶液
- D.碳酸钠饱和溶液
B
解析:
CO2在碳酸氢钠饱和溶液中的溶解度较小,且SO2在溶液中又可与NaHCO3反应生成CO2。
解析:
CO2在碳酸氢钠饱和溶液中的溶解度较小,且SO2在溶液中又可与NaHCO3反应生成CO2。

练习册系列答案
 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案
相关题目
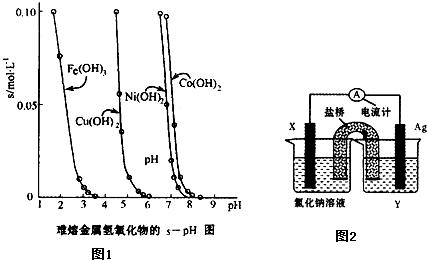
 金属氢氧化物在酸中溶解度不同,因此可以利用这一性质,控制溶液的pH,达到分离金属离子的目的.难溶金属的氢氧化物在不同pH下的溶解度(s,mol?L-1)见图.
金属氢氧化物在酸中溶解度不同,因此可以利用这一性质,控制溶液的pH,达到分离金属离子的目的.难溶金属的氢氧化物在不同pH下的溶解度(s,mol?L-1)见图.
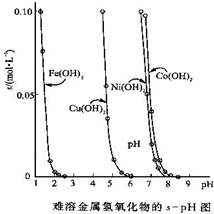 金属氢氧化物在酸中溶解度不同,因此可以利用这一性质,控制溶液的pH,达到分离金属离子的目的.难溶金属的氢氧化物在不同pH下的溶解度(s,mol?L-1)如图.
金属氢氧化物在酸中溶解度不同,因此可以利用这一性质,控制溶液的pH,达到分离金属离子的目的.难溶金属的氢氧化物在不同pH下的溶解度(s,mol?L-1)如图.