题目内容
下列关于原子结构、元素性质的说法正确的是( )
分析:A.铵盐属于离子化合物;
B.同周期自左而右原子半径减小,同主族自上而下原子半径增大;电子层结构相同,核电荷数越大离子半径越小;
C.
X和
X质子数相同,互为同位素,核外电子数相同;
D.阴离子还原性越强,其元素的非金属性越弱.金属性越强,最高价含氧酸的酸性越强.
B.同周期自左而右原子半径减小,同主族自上而下原子半径增大;电子层结构相同,核电荷数越大离子半径越小;
C.
293 117 |
294 117 |
D.阴离子还原性越强,其元素的非金属性越弱.金属性越强,最高价含氧酸的酸性越强.
解答:解:A.铵盐由非金属性元素组成,属于离子化合物,含有离子键,故A错误;
B.同周期自左而右原子半径减小,同主族自上而下原子半径增大,故原子半径Na>O.Na+、O2-电子层结构相同,核电荷数越大离子半径越小,故离子半径Na+<O2-,故B正确;
C.
X和
X质子数相同,互为同位素,核外电子数相同,故C错误;
D.ⅦA族元素的阴离子还原性越强,其元素的非金属性越弱,最高价含氧酸的酸性越弱,故D错误;
故选B.
B.同周期自左而右原子半径减小,同主族自上而下原子半径增大,故原子半径Na>O.Na+、O2-电子层结构相同,核电荷数越大离子半径越小,故离子半径Na+<O2-,故B正确;
C.
293 117 |
294 117 |
D.ⅦA族元素的阴离子还原性越强,其元素的非金属性越弱,最高价含氧酸的酸性越弱,故D错误;
故选B.
点评:本题考查半径比较、原子结构、元素周期律、化学键等,难度不大,注意元素周期律的掌握.

练习册系列答案
相关题目
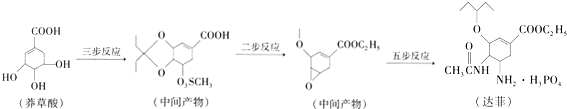
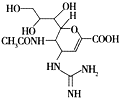




 ,关于盐酸乙哌立松片有下列说法:
,关于盐酸乙哌立松片有下列说法: