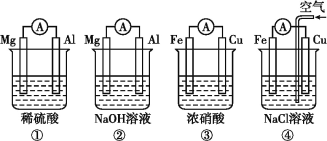
题目内容
【题目】如图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化,下列说法错误的是

A. 该反应的热化学方程式为:N2(g)+O2(g)═2NO(g)△H=+180kJ·mol﹣1
B. 1mol N2(l)和NA个O2(l)反应生成2mol NO(g)时,吸收的能量为180kJ
C. 1mol N2(g)和1mol O2(g)具有的总能量小于2mol NO(g)具有的总能量
D. 通常情况下,N2(g)和O2(g)混合不能直接生成NO(g)
【答案】B
【解析】
A、△H=反应物断裂化学键吸收的能量-生成物形成化学键放出的能量,则反应N2(g)+O2(g)=2NO(g)的反应热△H=946kJ/mol+498kJ/mol-2×632kJ/mol=+180kJ/mol,A正确;
B、由A可知,应该是1mol N2(g)和NA个O2(g)反应生成2mol NO(g)时,吸收的能量为180kJ,B错误;
C、N2(g)+O2(g)=2NO(g)△H=+180kJ/mol,为吸热反应,所以1mol N2(g)和1mol O2(g)具有的总能量小于2mol NO(g)具有的总能量,C正确;
D、通常情况下,N2(g)和O2(g)不能发生化学反应,一般需要高温或放电,D正确;
答案选B。
本题考查了反应能量变化的计算和判断,反应的焓变计算方法和能量守恒是解题的关键。注意反应热与键能以及物质总能量的关系。

练习册系列答案
 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案
相关题目