题目内容
某无色溶液,其中有可能存在的离子如下:Na+、Ag+、Ba2+、Al3+ S2-、AlO![]() 、、CO
、、CO![]() 、SO
、SO![]() 、SO
、SO![]() 。现取该溶液进行有关实验,实验结果如下所示
。现取该溶液进行有关实验,实验结果如下所示
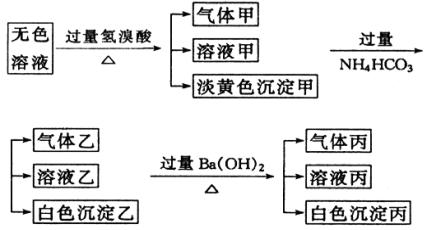
(1)沉淀甲是________,生成沉淀甲的离子方程式为________。
(2)沉淀乙是________,由溶液甲生成沉淀乙的离子方程式为________。
(3)沉淀丙是________,如何用一化学实验来确定其成分?答:________。
(4)气体甲成分有哪几种可能?答:________。
(5)综合上述信息,可以肯定存在的离子有________。
答案:
解析:
提示:
解析:
| (1)S;2S2-+ SO32- +6H+===3S↓++3H2O
(2) Al(OH)3;Al3++3HCO3-===Al(OH)3↓+3CO2↑ (3)BaCO3,也可能有BaSO4;在沉淀丙中加足量盐酸,若沉淀不会溶解,说明除BaCO3外还有BaSO4,若沉淀全溶解,则仅有BaCO3。 (4)①CO2 ②H2S ③CO2、H2S ④SO2 ⑤SO2、CO2 (5)S2-、Na+、 SO
|
提示:
| 根据特征反应的现象进行鉴别。过量酸有气体生成,表明溶液中可能有S2-、CO 所以是来自 AlO
|

练习册系列答案
相关题目
