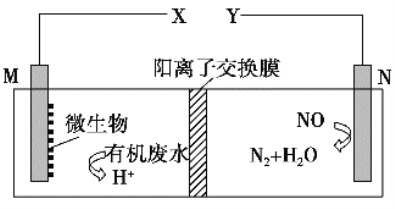
��Ŀ����
����Ŀ�����м�������ȷ����
A. 32.5 g Zn��һ����Ũ������ȫ��Ӧ�����ɵ����������ĿС��0.5NA
B. 2H2S��SO2 = 3S����2H2O��Ӧ�����������뻹ԭ��������ʵ���֮��Ϊ1 : 2
C. ��NO2��O2�������ϳ����Թܣ�������ˮ���г�ַ�Ӧ���Թ���ʣ������ռ�Թ��ݻ���1/8
D. ���³�ѹ��(Vm=24.5L/mol)�����ſ������ռ�HCl�����ڸ�����ƿ����Ȫʵ�飬������ƿ����Һ�����磬������������ʵ���Ũ��Ϊ1/24.5 mol/L
���𰸡�D
��������
A. Ũ������п��Ӧ�ķ���ʽZn+2H2SO4![]() ZnSO4+SO2��+2H2O���ӷ���ʽ���Կ���1molп����1mol�����������壬������������ĺ�ˮ�����ɣ������ϡ����ʱ�ͻᷢ��п��ϡ���ᷴӦ��Zn+H2SO4=ZnSO4+H2�����ӷ���ʽ���Կ���1molп����1mol����������1molп������Ũ���ᷴӦ������ϡ���ᷴӦ���������嶼Ϊ1mol��32.5 gп�����ʵ���Ϊn =
ZnSO4+SO2��+2H2O���ӷ���ʽ���Կ���1molп����1mol�����������壬������������ĺ�ˮ�����ɣ������ϡ����ʱ�ͻᷢ��п��ϡ���ᷴӦ��Zn+H2SO4=ZnSO4+H2�����ӷ���ʽ���Կ���1molп����1mol����������1molп������Ũ���ᷴӦ������ϡ���ᷴӦ���������嶼Ϊ1mol��32.5 gп�����ʵ���Ϊn = ![]() =
= ![]() = 0.5 mol���������������Ϊ0.5 NA��A�����
= 0.5 mol���������������Ϊ0.5 NA��A�����
B. ��������ԭ��������������������������������������ǻ�ԭ������ԣ�����Ӧ������3mol������2mol��Ϊ�������1mol��Ϊ��ԭ��������������뻹ԭ��������ʵ���֮��Ϊ2:1��B�����
C. ��NO2��O2�������ϳ���һ�Թܣ�������ˮ���У�����![]() �����Թܵ����Ϊ8����NO2��O2�������4�����ݷ���ʽ��4�����NO2����1�����������ʣ�����������Ϊ3�������Թ���ʣ������ռ�Թ��ݻ���3/8��C�����
�����Թܵ����Ϊ8����NO2��O2�������4�����ݷ���ʽ��4�����NO2����1�����������ʣ�����������Ϊ3�������Թ���ʣ������ռ�Թ��ݻ���3/8��C�����
D. ��HCl�����ΪVL����״���£�n��HCl��=![]() ��Һ�����ճ��������Թܣ��ٶ����ʲ���ɢ����Һ�����ΪV L����c=
��Һ�����ճ��������Թܣ��ٶ����ʲ���ɢ����Һ�����ΪV L����c= =1/24.5 mol/L��D����ȷ��
=1/24.5 mol/L��D����ȷ��
��ѡD��

 ��һ������ĩ�ٷֳ�̾�ϵ�д�
��һ������ĩ�ٷֳ�̾�ϵ�д�����Ŀ��NH3��Ϊ��Ҫ����ԭ�ϣ�������Ӧ���ڹ�ҵ�����������й����ʷ�Ӧ�Ĵ����о������������863�ƻ���
��1�����Ĵ�������Ӧ:4 NH3��g��+5O2��g��![]() 4NO��g��+6H2O��g�� ��H< 0����������Ļ�����Ӧ�����ݻ��̶����ܱ������з���������Ӧ�������ڲ������ʵ����ʵ���Ũ�����±���
4NO��g��+6H2O��g�� ��H< 0����������Ļ�����Ӧ�����ݻ��̶����ܱ������з���������Ӧ�������ڲ������ʵ����ʵ���Ũ�����±���
Ũ�� ʱ�� | C(NH3) mol/L | C(O2) mol/L | C(NO) mol/L |
��0 min | 0.8 | 1.6 | 0 |
��1 min | a | 1.35 | 0.2 |
��2 min | 0.3 | 0.975 | 0.5 |
��3 min | 0.3 | 0.975 | 0.5 |
��4 min | 0.7 | 1.475 | 0.1 |
�ٷ�Ӧ�ڵ�1min����2minʱ��NH3��ƽ����Ӧ����Ϊ______________��
�ڷ�Ӧ�ڵ�3 minʱ�ı����������ı������������___________������ţ���
A��ʹ�ô��� B����Сѹǿ C�������¶� D������O2��Ũ��
��˵��4NH3��g��+5O2��g��![]() 4NO��g��+6 H2O��g���ﵽƽ��״̬����____������ţ���
4NO��g��+6 H2O��g���ﵽƽ��״̬����____������ţ���
A����λʱ��������n mol NO��ͬʱ����n mol NH3
B���ٷֺ���w��NH3��=w��NO��
C����Ӧ����v��NH3����v��O2����v��NO����v��H2O��=4��5��4��6
D���ں��º��ݵ������У���������ƽ����Է����������ٱ仯
��2�������ݻ�Ϊ2L���ܱ������г���4.0molNH3(g)��5.0molO2(g)���������·�Ӧ��4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g)�����������������䣬����ͬ��ʱ���ڲ��c(NO)���¶ȵĹ�ϵ����ͼ1��ʾ���� T1���£�NH3��ƽ��ת����Ϊ______��
4NO(g)+6H2O(g)�����������������䣬����ͬ��ʱ���ڲ��c(NO)���¶ȵĹ�ϵ����ͼ1��ʾ���� T1���£�NH3��ƽ��ת����Ϊ______��
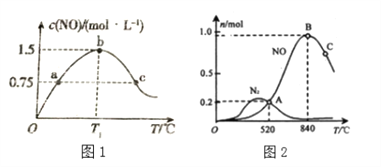
��3����������ʱ�ᷢ������������Ӧ���ֱ�Ϊ
��ӦI��4NH![]() 4NO(g) +6H2O(g) ��H= -905.0 kJ��mol-1
4NO(g) +6H2O(g) ��H= -905.0 kJ��mol-1
��ӦII: 4NH3(g)+3O2(g)![]() 2N2(g) +6H2O(g) ��H= -1266.6 kJ��mol-1��
2N2(g) +6H2O(g) ��H= -1266.6 kJ��mol-1��
Ϊ����ij�����Ը÷�Ӧ��ѡ���ԣ���1L�ܱ������г���1 mol NH3��2mol O2������й����ʵ�����ϵ����ͼ2��
�ٸô����ڵ���ʱѡ��Ӧ_______(� I ���� II������
��C���B����������NO�����ʵ����ٵ���Ҫԭ��______________________________����4��ͨ����������������Ӧд��NO�ֽ�����N2��O2���Ȼ�ѧ����ʽ________________��
����Ŀ����һ���¶��£���H2��I2(g)��0.16mol����10L�����ܱ������У�������ӦH2(g)+I2(g)![]() 2HI(g) ��H<0��һ��ʱ���ﵽƽ�⣬��Ӧ�����вⶨ����������:
2HI(g) ��H<0��һ��ʱ���ﵽƽ�⣬��Ӧ�����вⶨ����������:
t/min | 2 | 4 | 7 | 9 |
N(I2)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
����˵������ȷ����
A. ��Ӧǰ4min��ƽ������v(HI)=2.5��10-3mol/(Lmin)
B. ����ϵѹǿ���ٸı�ʱ�����жϷ�Ӧ�ﵽƽ��״̬
C. ���¶��´˷�Ӧ����ⳣ��K=1.44
D. �ٳ���0.05molH2��0 .05molI2(g)��0.06molHI,ƽ�ⲻ�ƶ�