题目内容
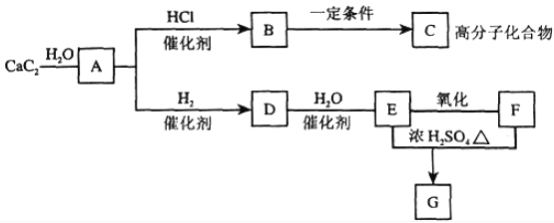
【题目】为探究X(仅含三种元素)的组成和热稳定性,设计并完成如下实验:
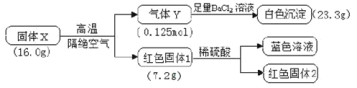
气体Y不能使品红溶液褪色,红色固体1是一种纯净物,请回答:
(1)X除了含有Cu元素之外,还有___元素(填元素符号)。
(2)该流程中X高温分解的化学方程式为____。
(3)写出气体Y通入BaCl2溶液发生反应的离子方程式___。
【答案】S、O 4CuSO4![]() 2Cu2O+4SO3↑+O2↑ SO3+H2O+Ba2+=2H++BaSO4↓或SO3+H2O=2H++SO42-、SO42-+Ba2+=BaSO4↓
2Cu2O+4SO3↑+O2↑ SO3+H2O+Ba2+=2H++BaSO4↓或SO3+H2O=2H++SO42-、SO42-+Ba2+=BaSO4↓
【解析】
16.0g固体X高温隔绝空气分解生成0.125mol气体Y和7.2g红色固体1,由质量守恒定律可知,气体Y的质量为8.8g,气体Y与足量BaCl2溶液作用生成的白色沉淀为BaSO4,质量为23.3g,其物质的量为![]() =0.1mol,则混合气体中含有0.1molSO3,另一种气体的物质的量为0.025mol,质量为8.8g-0.1mol×80g/mol=0.8g,则该气体的摩尔质量为
=0.1mol,则混合气体中含有0.1molSO3,另一种气体的物质的量为0.025mol,质量为8.8g-0.1mol×80g/mol=0.8g,则该气体的摩尔质量为![]() =32g/mol,此气体为O2,即气体Y为SO3和O2的混合气体,且物质的量之比为0.1mol:0.025mol=4:1;纯净的红色固体1溶于稀硫酸得到蓝色溶液和红色固体2,可知溶液中含有Cu2+,红色固体2为Cu,则红色固体1为Cu2O,其物质的量为
=32g/mol,此气体为O2,即气体Y为SO3和O2的混合气体,且物质的量之比为0.1mol:0.025mol=4:1;纯净的红色固体1溶于稀硫酸得到蓝色溶液和红色固体2,可知溶液中含有Cu2+,红色固体2为Cu,则红色固体1为Cu2O,其物质的量为![]() =0.05mol,由此可知X有Cu、S、O三种元素组成,三者的物质的量比为(0.05mol×2):0.1mol:(0.05mol+0.1mol×3+0.025mol×2)=1:1:4,则固体X为CuSO4,据此分析解题。
=0.05mol,由此可知X有Cu、S、O三种元素组成,三者的物质的量比为(0.05mol×2):0.1mol:(0.05mol+0.1mol×3+0.025mol×2)=1:1:4,则固体X为CuSO4,据此分析解题。
16.0g固体X高温隔绝空气分解生成0.125mol气体Y和7.2g红色固体1,由质量守恒定律可知,气体Y的质量为8.8g,气体Y与足量BaCl2溶液作用生成的白色沉淀为BaSO4,质量为23.3g,其物质的量为![]() =0.1mol,则混合气体中含有0.1molSO3,另一种气体的物质的量为0.025mol,质量为8.8g-0.1mol×80g/mol=0.8g,则该气体的摩尔质量为
=0.1mol,则混合气体中含有0.1molSO3,另一种气体的物质的量为0.025mol,质量为8.8g-0.1mol×80g/mol=0.8g,则该气体的摩尔质量为![]() =32g/mol,此气体为O2,即气体Y为SO3和O2的混合气体,且物质的量之比为0.1mol:0.025mol=4:1;纯净的红色固体1溶于稀硫酸得到蓝色溶液和红色固体2,可知溶液中含有Cu2+,红色固体2为Cu,则红色固体1为Cu2O,其物质的量为
=32g/mol,此气体为O2,即气体Y为SO3和O2的混合气体,且物质的量之比为0.1mol:0.025mol=4:1;纯净的红色固体1溶于稀硫酸得到蓝色溶液和红色固体2,可知溶液中含有Cu2+,红色固体2为Cu,则红色固体1为Cu2O,其物质的量为![]() =0.05mol,由此可知X有Cu、S、O三种元素组成,三者的物质的量比为(0.05mol×2):0.1mol:(0.05mol+0.1mol×3+0.025mol×2)=1:1:4,则固体X为CuSO4;
=0.05mol,由此可知X有Cu、S、O三种元素组成,三者的物质的量比为(0.05mol×2):0.1mol:(0.05mol+0.1mol×3+0.025mol×2)=1:1:4,则固体X为CuSO4;
(1)由分析知:X除了含有Cu元素之外,还有S、O元素;
(2)X的分解产物为SO3、O2和Cu2O,三者的物质的量比为0.1mol:0.025mol:0.05mol=4:1:2,则CuSO4高温分解的化学方程式为4CuSO4![]() 2Cu2O+4SO3↑+O2↑;
2Cu2O+4SO3↑+O2↑;
(3)气体Y为SO3和O2的混合气体,通入BaCl2溶液生成BaSO4沉淀,发生反应的离子方程式为SO3+H2O+Ba2+=2H++BaSO4↓或SO3+H2O=2H++SO42-、SO42-+Ba2+=BaSO4↓。

 阅读快车系列答案
阅读快车系列答案【题目】硫酸镍是电镀工业必不可少的化工原料。从不锈钢废渣(主要含Fe42.35%、Cr9.67%、Ni5.1%、C4.7%、Si3.39%等)中制取硫酸镍晶体的工艺流程如图:
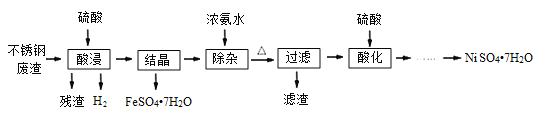 已知:①Cr3+与氨水反应时有少量Cr3+生成[Cr(NH3)6]3+,但加热时该络合物易分解。Ni2+与氨水反应生成[Ni(NH3)6]2+,该络合物加热时稳定,用硫酸酸化时生成相应的硫酸盐。
已知:①Cr3+与氨水反应时有少量Cr3+生成[Cr(NH3)6]3+,但加热时该络合物易分解。Ni2+与氨水反应生成[Ni(NH3)6]2+,该络合物加热时稳定,用硫酸酸化时生成相应的硫酸盐。
②Na2CrO4溶液中加酸调节pH为3.5时,CrO42-转化为Cr2O72-。
③相关物质在不同温度时溶解度如下表:
温度 溶解度/g 物质 | 20℃ | 30℃ | 40℃ | 60℃ | 80℃ | 90℃ |
Na2SO4 | 19.5 | 40.8 | 48.8 | 45.3 | 43.7 | 42.7 |
Na2Cr2O7 | 183 | 198 | 215 | 269 | 376 | 405 |
(1)“酸浸”后得到的溶液中主要含有FeSO4、NiSO4、Cr2(SO4)3,生成NiSO4的化学方程式为___。“酸浸”时需控制温度为90℃左右,可以采用的加热方式是___。
(2)“过滤”前,适当加热的目的是___。
(3)对“过滤”所得的滤渣进行洗涤,检验滤渣已洗涤干净的方法是___。
(4)“过滤”时产生的滤渣可用于制备Na2Cr2O7晶体。
①滤渣经干燥后与Na2CO3混合在空气中煅烧生成Na2CrO4和CO2,此反应的化学方程式为___。
②请补充完整上述煅烧后混合物制备Na2Cr2O7晶体(橙红色)的实验方案:水浸,过滤,___,烘干得Na2Cr2O7晶体(必须使用的试剂有:硫酸,蒸馏水)。