题目内容
【题目】铁及铁的化合物在生产与生活中有重要的意义。工业上制备无水FeCl3的一种工艺如下:

(1)吸收塔中吸收剂X是 ____________________。
(2)温度超过673 K,捕集器中的物质相对分子质量为325,该物质的化学式为______是__________________ (填’“离子化合物”或“共价化合物”)
(3)从FeCl3溶液中获得FeCl3·6H2O的方法是__________________________。
(4)向饱和氯化铁溶液中加入足量的氢氧化钠溶液后再加入次氯酸钠可制备高铁酸钠Na2FeO4溶液。写出制备高铁酸钠的离子方程式:________________________
(5)低温下,在高铁酸钠溶液中加入KOH至饱和可析出高铁酸钾(K2FeO4),最可能的原因是______________________。
(6)高铁电池的总反应为3Zn+2K2FeO4+8H2O![]() 3Zn(OH)2+2Fe(OH)3+4KOH。则高铁放电时,____(填“正”或“负”)极附近溶液的碱性增强。电池正极反应为_________________
3Zn(OH)2+2Fe(OH)3+4KOH。则高铁放电时,____(填“正”或“负”)极附近溶液的碱性增强。电池正极反应为_________________
【答案】FeCl2溶液 Fe2Cl6 共价化合物 加热浓缩,冷却结晶 2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O 高铁酸钾溶解度小于高铁酸钠 正 FeO42-+3e-+4H2O═Fe(OH)3+5OH-
【解析】
氯气和铁屑在反应炉内反应生成氯化铁,经捕集器和冷却器得到固体三氯化铁。从反应炉中排出的尾气是反应剩余的Cl2和少量氯化铁烟气,与吸收剂X在吸收塔中反应生成FeCl3溶液,同时溶解氯化铁烟气,则吸收剂X应是FeCl2溶液,据此分析解答。
(1) 通过工艺流程图可知,从反应炉中排出的尾气是反应剩余的Cl2和少量氯化铁烟气,与吸收剂X在吸收塔中反应生成FeCl3溶液,同时溶解氯化铁烟气,则吸收剂X应是FeCl2溶液,
故答案为:FeCl2溶液;
(2) 分子中Fe原子与Cl原子数目之比为1:3,令分子组成为(FeCl3)n,该分子相对分子质量为325,则:(56+35.5×3)×n=325,解得,n=2,所以该物质的分子式为Fe2Cl6;由流程可知Fe2Cl6熔沸点较低,为共价化合物,
故答案为:Fe2Cl6;共价化合物;
(3)氯化铁的溶解度随温度升高而增大,所以由FeCl3溶液获得FeCl3·6H2O晶体需加热蒸发、冷却晶体,
故答案为:加热浓缩,冷却结晶;
(4) 利用次氯酸钠氧化氯化铁制备高铁酸钠,根据电子得失守恒以及原子守恒可知,反应的离子方程式为2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O ,
故答案为:2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O;
(5) 要发生复分解反应则必须满足有挥发性物质或难电离物质或难溶性物质,因此根据方程式2KOH+Na2FeO4=K2FeO4+2NaOH可知,该反应之所以能发生是由于K2FeO4溶解度小,析出晶体,促进反应进行,
故答案为:高铁酸钾溶解度小于高铁酸钠;
(6) 根据电池反应式知,放电时,高铁酸钾得电子而作正极,电极反应式为FeO42-+3e-+4H2O═Fe(OH)3+5OH-,反应生成OH-,氢氧根离子浓度增大,所以正极附近溶液碱性增强,
故答案为:正;FeO42-+3e-+4H2O═Fe(OH)3+5OH-。

【题目】Ⅰ.氮的固定一直是科学家研究的重要课题,合成氨则是人工固氮比较成熟的技术,其原理为N2 (g)+3H2 (g)![]() 2NH3(g)。
2NH3(g)。
(1)已知每破坏1mol有关化学键需要的能量如下表:
H-H | N-H | N-N | N≡N |
435.9KJ | 390.8KJ | 192.8KJ | 945.8KJ |
(1)则反应物的总能量_________(填“>”或 “<”)生成物的总能量。
(2)在一定温度下、向2L密闭容器中加入2 molN2、6 mol H2,在适当的催化剂作用下,发生反应 N2 (g)+3H2 (g)![]() 2NH3(g),10min后达到平衡,此时剩余4.5mol H2。
2NH3(g),10min后达到平衡,此时剩余4.5mol H2。
①下列叙述能说明此反应达到平衡状态的是________________________。
a.容器内总压强不变 b.v(H2)正=v(H2)逆 c.N2和H2的浓度相等
d. 2 mol NH3生成的同时有3 moH—H键断裂 e.NH3的浓度不再改变
②0~10 min内的平均反应速率v(H2) 是______mol/(Lmin);10秒末NH3的浓度是______mol/L;N2 的的物质的量________mol
Ⅱ.某温度时,在一个2L的密闭容器中X、Y、Z三种气体物质的物质的量随时间的变化曲线如图所示,据此回答:
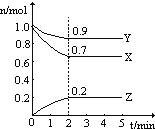
(1)该反应的化学方程式为_______________________。
(2)从开始至2min,Z的平均反应速率为____________mol/(L·min);
(3)改变下列条件,可以加快化学反应速率的有_________。
A.升高温度 B.减小物质X的物质的量 C.减小压强 D.增加物质Z的物质的量 E.缩小容积
F.使用效率更高的催化剂
(4)该反应正向为放热反应若上述容器为绝热容器(与外界无热交换),则到达平衡所需时间将______。
a.延长 b.缩短 c.不变 d.无法确定