��Ŀ����
 ͼ��ʾ��ת����ϵ�У��ס��Ҽ�A��B��C��D��E��Ϊ��ѧ�����Ļ�ѧ���ʣ����мס���Ϊ�����A��B��DΪ���ʣ�
ͼ��ʾ��ת����ϵ�У��ס��Ҽ�A��B��C��D��E��Ϊ��ѧ�����Ļ�ѧ���ʣ����мס���Ϊ�����A��B��DΪ���ʣ�
��1����A��BΪ�������ʣ��ڳ�����CΪ��ɫҺ�壻�׳�����ɫ��������ϣ��������ռ���Һ�������______�����׳ƣ����������ռ���Һ�����ӷ���ʽΪ______����Ӧ�ڵĻ�ѧ����ʽΪ______��
��2����A��BΪͬ����ǽ������ʣ�E��ˮ��Һ�ʼ��ԣ������м������ϡ���ᣬ���ɰ�ɫ��״���������������ȡ______�������֣���ԭ�ϣ���E��Һ��ͨ�����������̼����Ӧ�����ӷ���ʽΪ______��A��Ũ���ᷴӦ�Ļ�ѧ����ʽΪ______��
�⣺��1���ڳ�����CΪ��ɫҺ�壬ӦΪH2O���׳�����ɫ��������ϣ�ӦΪFe2O3���׳����죬��Ϊ����������ռ���Һ��ӦΪAl2O3����AΪAl��BΪFe����ˮ��Ӧ����Fe3O4��H2��Al2O3�����ռ���Һ�����ӷ���ʽΪAl2O3+2OH-=2AlO2-+H2O��Fe��ˮ��Ӧ�ķ���ʽΪ3Fe+4H2O��g�� Fe3O4+4H2��
Fe3O4+4H2��
�ʴ�Ϊ�����죻 Al2O3+2OH-=2AlO2-+H2O��3Fe+4H2O��g�� Fe3O4+4H2��
Fe3O4+4H2��
��2��A��BΪͬ����ǽ������ʣ�A�ͼķ�ӦΪ�û���Ӧ��E��ˮ��Һ�ʼ��ԣ������м������ϡ���ᣬ���ɰ�ɫ��״�������ð�ɫ����ӦΪH2SiO3����˵��AΪC����ΪSiO2��������������ά�����������ȣ���ΪCO��BΪSi��E��ˮ��Һ�ʼ��ԣ�ӦΪNa2SiO3��K2SiO3��CΪNaOH��KOH��DΪH2����E��Һ��ͨ�����������̼����Ӧ�����ӷ���ʽΪSiO32-+2CO2+2H2O=H2SiO3��+2HCO3-��C��Ũ�����ڼ��������·���������ԭ��Ӧ����Ӧ�ķ���ʽΪC+2H2SO4��Ũ�� CO2��+2SO2��+2H2O��
CO2��+2SO2��+2H2O��
�ʴ�Ϊ�����ά�����������ȣ�SiO32-+2CO2+2H2O=H2SiO3��+2HCO3-��C+2H2SO4��Ũ�� CO2��+2SO2��+2H2O��
CO2��+2SO2��+2H2O��
��������1���ڳ�����CΪ��ɫҺ�壬ӦΪH2O���׳�����ɫ��������ϣ�ӦΪFe2O3����Ϊ����������ռ���Һ��ӦΪAl2O3����AΪAl��BΪFe����ˮ��Ӧ����Fe3O4��H2��
��2��A��BΪͬ����ǽ������ʣ�A�ͼķ�ӦΪ�û���Ӧ��E��ˮ��Һ�ʼ��ԣ������м������ϡ���ᣬ���ɰ�ɫ��״�������ð�ɫ����ӦΪH2SiO3����˵��AΪC����ΪSiO2����ΪCO��BΪSi��E��ˮ��Һ�ʼ��ԣ�ӦΪNa2SiO3��K2SiO3��CΪNaOH��KOH��DΪH2�������ĿҪ������ʵ����ʽ����⣮
���������⿼��������ƶϣ���Ŀ�Ѷ��еȣ�����ע��������ʵ���ɫ����;�Լ���Ӧ��ת����ϵΪ�ƶϸ����ͻ�ƿڣ�ѧϰ��Ҫ�ص���ճ���Ԫ�ػ���������ʣ�
 Fe3O4+4H2��
Fe3O4+4H2���ʴ�Ϊ�����죻 Al2O3+2OH-=2AlO2-+H2O��3Fe+4H2O��g��
 Fe3O4+4H2��
Fe3O4+4H2����2��A��BΪͬ����ǽ������ʣ�A�ͼķ�ӦΪ�û���Ӧ��E��ˮ��Һ�ʼ��ԣ������м������ϡ���ᣬ���ɰ�ɫ��״�������ð�ɫ����ӦΪH2SiO3����˵��AΪC����ΪSiO2��������������ά�����������ȣ���ΪCO��BΪSi��E��ˮ��Һ�ʼ��ԣ�ӦΪNa2SiO3��K2SiO3��CΪNaOH��KOH��DΪH2����E��Һ��ͨ�����������̼����Ӧ�����ӷ���ʽΪSiO32-+2CO2+2H2O=H2SiO3��+2HCO3-��C��Ũ�����ڼ��������·���������ԭ��Ӧ����Ӧ�ķ���ʽΪC+2H2SO4��Ũ��
 CO2��+2SO2��+2H2O��
CO2��+2SO2��+2H2O���ʴ�Ϊ�����ά�����������ȣ�SiO32-+2CO2+2H2O=H2SiO3��+2HCO3-��C+2H2SO4��Ũ��
 CO2��+2SO2��+2H2O��
CO2��+2SO2��+2H2O����������1���ڳ�����CΪ��ɫҺ�壬ӦΪH2O���׳�����ɫ��������ϣ�ӦΪFe2O3����Ϊ����������ռ���Һ��ӦΪAl2O3����AΪAl��BΪFe����ˮ��Ӧ����Fe3O4��H2��
��2��A��BΪͬ����ǽ������ʣ�A�ͼķ�ӦΪ�û���Ӧ��E��ˮ��Һ�ʼ��ԣ������м������ϡ���ᣬ���ɰ�ɫ��״�������ð�ɫ����ӦΪH2SiO3����˵��AΪC����ΪSiO2����ΪCO��BΪSi��E��ˮ��Һ�ʼ��ԣ�ӦΪNa2SiO3��K2SiO3��CΪNaOH��KOH��DΪH2�������ĿҪ������ʵ����ʽ����⣮
���������⿼��������ƶϣ���Ŀ�Ѷ��еȣ�����ע��������ʵ���ɫ����;�Լ���Ӧ��ת����ϵΪ�ƶϸ����ͻ�ƿڣ�ѧϰ��Ҫ�ص���ճ���Ԫ�ػ���������ʣ�

��ϰ��ϵ�д�
 ����С״Ԫ��������������ϵ�д�
����С״Ԫ��������������ϵ�д�
�����Ŀ
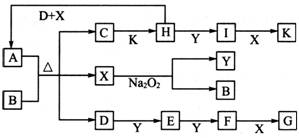
 ����ͼ��ʾ��ת����ϵ�У�A��B��C����ѧ��ѧ�г��������ʣ�������ͬһ��Ԫ��R��������Ԫ����������������18���ش��������⣮��˵����ͼ�в���R�IJ��������ȥ����Ӧ�ڵIJ���֮һ��A��
����ͼ��ʾ��ת����ϵ�У�A��B��C����ѧ��ѧ�г��������ʣ�������ͬһ��Ԫ��R��������Ԫ����������������18���ش��������⣮��˵����ͼ�в���R�IJ��������ȥ����Ӧ�ڵIJ���֮һ��A��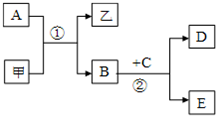 ͼ��ʾ��ת����ϵ�У��ס��Ҽ�A��B��C��D��E��Ϊ��ѧ�����Ļ�ѧ���ʣ����мס���Ϊ�����A��B��DΪ���ʣ�
ͼ��ʾ��ת����ϵ�У��ס��Ҽ�A��B��C��D��E��Ϊ��ѧ�����Ļ�ѧ���ʣ����мס���Ϊ�����A��B��DΪ���ʣ�

 2I��g����
2I��g����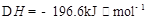 ��������4 mol H��2 mol Y�ų�345 kJ������ʱ��H��ת������ӽ���__________������ĸ����
��������4 mol H��2 mol Y�ų�345 kJ������ʱ��H��ת������ӽ���__________������ĸ����