题目内容
14.大气污染物主要成分是SO2、NO2、CxHy及可吸入颗粒等,主要来自于燃煤、机动车尾气和工业废气.(1)上述成分中能形成酸雨的是SO2 和 NO2(填化学式).
(2)煤的气化是高效、清洁利用煤炭的重要途径之一.利用煤的气化获得的水煤气(主要成分为CO、CO2和
H2)在催化剂作用下可以合成绿色燃料甲醇.
已知:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H1=-58.7kJ•mol-1
CO2(g)+H2(g)?CO(g)+H2O(g)△H2=+41.0kJ•mol-1
CO 与 H2生成 CH3OH 气体反应的热化学方程式是CO(g)+2H2(g)=CH3OH(g)△H=-99.7 kJ•mol-1.
(3)空气质子交换法治理SO2,其原理是将含有SO2的烟气与O2通过电化学反应制得硫酸,负极的电极反应式是SO2+2H2O-2e-=SO42-+4H+.
(4)湿法吸收工业尾气中的NO2,常选用纯碱溶液,将NO2转化为两种氮元素的常见含氧酸盐.反应的离子方程式是CO32-+2NO2=NO2-+NO3-+CO2.
(5)用高能电子束激活烟气(主要成分是SO2、NO2、H2O等),会产生O3等强氧化性微粒.烟气经下列过程可获得化肥.
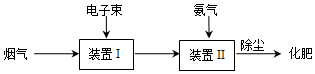
该化肥中含有的离子是NH4+、SO42-、NO3-(填离子符号).
分析 (1)二氧化硫和氮氧化物是形成酸雨的主要气体;
(2)结合热化学方程式和盖斯定律计算得到所需热化学方程式,
①CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H1=-58.7kJ•mol-1
②CO2(g)+H2(g)?CO(g)+H2O(g)△H2=+41.0kJ•mol-1
盖斯定律计算①-②得到CO 与 H2生成 CH3OH 气体反应的热化学方程式;
(3)原电池中负极是二氧化硫失电子被氧化为硫酸,结合电话守恒书写电极反应;
(4)纯碱溶液,将NO2转化为两种氮元素的常见含氧酸盐,结合原子守恒和氧化还原反应电子守恒分析反应生成硝酸盐和亚硝酸盐;
(5)电子束脱硫技术是一种物理与化学方法相结合的高新技术.它利用电子加速器产生的等离子体氧化烟气中的SO2、NO2,并与注入的NH3反应,生成硫铵和硝铵化肥,实现脱硫、脱硝目的;
解答 解:(1)二氧化硫和氮氧化物是形成酸雨的主要气体,
故答案为:SO2 和 NO2;
(2)①CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H1=-58.7kJ•mol-1
②CO2(g)+H2(g)?CO(g)+H2O(g)△H2=+41.0kJ•mol-1
盖斯定律计算①-②得到CO 与 H2生成 CH3OH 气体反应的热化学方程式CO(g)+2H2(g)=CH3OH(g)△H=-99.7 kJ•mol-1,
故答案为:CO(g)+2H2(g)=CH3OH(g)△H=-99.7 kJ•mol-1;
(3)空气质子交换法治理SO2,电解质溶液为酸性溶液,其原理是将含有SO2的烟气与O2通过电化学反应制得硫酸,负极的电极反应式是:SO2+2H2O-2e-=SO42-+4H+,
故答案为:SO2+2H2O-2e-=SO42-+4H+;
(4)纯碱溶液,将NO2转化为两种氮元素的常见含氧酸盐,结合原子守恒和氧化还原反应电子守恒分析反应生成硝酸盐和亚硝酸盐,反应的离子方程式为:CO32-+2NO2=NO2-+NO3-+CO2,
故答案为:CO32-+2NO2=NO2-+NO3-+CO2;
(5)在辐射场中,燃煤烟气中的主要成分O2、H2O(气),吸收高能电子的能量,生成大量反应活性极强的活性基团和氧化性物质,如O、OH、O3、H2O.这些氧化性物质与气态污染物进行各种氧化反应,举例如下:
SO2+2OH→H2SO4
NO+O→NO2
NO2+OH→HNO3
生成的H2SO4和HNO3 与加入的NH3发生如下反应:
H2SO4+2NH3→(NH4)2SO4
HNO3+NH3 →NH4NO3,
该化肥中含有的离子是NH4+、SO42-、NO3-,
故答案为:NH4+、SO42-、NO3-;
点评 本题考查了环境保护和废气处理方法,主要是热化学方程式书写、原电池原理应用、离子方程式书写等,注意知识积累,题目难度中等.

 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案| 实验目的 | 实验操作 | |
| A | 证明溶液中一定含有SO32- | 将该溶液与稀盐酸反应产生的气体通入澄清石灰水,有白色沉淀生成 |
| B | 证明氯气中混有氯化氢气体 | 将该混合气体通入AgNO3溶液中,有白色沉淀生成 |
| C | 证明某固体中有Na+,无K+ | 灼烧该固体,火焰呈黄色 |
| D | 证明Br-还原性强于Cl- | 向NaBr溶液中滴入少量氯水和苯,振荡、静置,溶液上层呈橙红色 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 标准状况下,22.4LH2O含有分子数为1NA | |
| B. | 常温常压下,224LH2和O2的混合气体所含分子数为NA | |
| C. | 通常状况下,1molCl2与足量Na反应转移电子数为NA | |
| D. | 常温下,2.7g铝与足量的盐酸反应,失去的电子数为0.3NA |

| A. | 化合物1和化合物2均能使酸性KMnO4溶液褪色 | |
| B. | 化合物1的核磁共振氢谱测出5个谱峰 | |
| C. | PASNa与足量盐酸反应生成如上图化合物2 | |
| D. | 通入足量CO2能将图化合物3转化为PASNa |
| A. | Ag+ | B. | Mg2+ | C. | S042- | D. | OH- |
| 选项 | 性质 | 实际应用 |
| A | 氧化铝的熔点高 | 作耐火材料 |
| B | 铁比铜金属活动性强 | 氯化铁溶液腐蚀铜刻制印刷电路板 |
| C | 硅胶多孔,吸水强 | 作袋装食品的干燥剂 |
| D | 金属化合物灼烧有特殊颜色 | 作节日燃放的烟花 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 加成反应、取代反应 | B. | 加成反应、消去反应 | ||
| C. | 氧化反应、加成反应 | D. | 消去反应、氧化反应 |

 .
. ;由E合成G的化学方程式为
;由E合成G的化学方程式为 .
.